如何制作和使用Percoll梯度
制作和稀释Percoll母液
为了配置Percoll(一种硅溶胶)梯度液,必须先用生理盐水或细胞培养基将Percoll(未稀释)渗透压调至生理盐溶液水平。用1份(v/v)1.5 M NaCl或10X浓缩细胞培养基稀释9份(v/v)Percoll,即可简单配成Percoll等渗母液(stock isotonic Percoll, SIP)。后续加入盐或蒸馏水可调到需要的渗透压。渗透压的改变会影响细胞密度(图6),因此需要定期用渗透压计检查母液渗透压,保证实验间的可重复性。对于在含盐溶液中会聚集的亚细胞颗粒,可改用1份(v/v)2.5 M蔗糖稀释9份(v/v)Percoll,配制Percoll等渗母液(SIP)。
SIP溶液的密度可根据下式计算:

式中:
Vx = 稀释用介质体积(mL)
Vo = 未稀释Percoll体积 (mL)
ρo = Percoll密度 (1.130 + 0.005 g/mL*)
ρ10 = 1.5 M NaCl密度 = 1.058 g/mL(其他盐类略有差别)
2.5 M蔗糖密度 = 1.316 g/mL(其他添加剂略有差别)
ρi = SIP溶液密度 (g/mL)
因此,对于生理盐水稀释的SIP,ri = 1.123 g/mL,对于蔗糖稀释的SIP,ri = 1.149 g/mL(设ro = 1.130 g/mL)。
*准确密度见产品检验报告(CoA)。
Percoll母液稀释至更低密度
为了将Percoll等渗母液(SIP)稀释至更低密度,只需添加0.15 M NaCl(或离子强度相当的细胞培养基)或0.25 M蔗糖即可,前者适合用于细胞,后者适合用于亚细胞颗粒或病毒。
通过下式可计算配制需要密度溶液的介质用量。
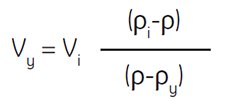
式中:
Vy = 稀释用介质体积,mL
Vi = SIP体积,mL
ρi = SIP密度,g/mL
ρy = 稀释用介质密度,g/mL
(0.15 M NaCl密度~1.0046 g/mL) *
(0.25 M蔗糖密度~1.032 g/mL)*
ρ = 稀释溶液密度,g/mL
举例:将55 mL SIP稀释至1.07 g/mL密度,所需0.15 M NaCl的体积计算。

以上公式获得的密度仅仅与需要密度非常接近,但并不能保证完全相同,因为加入体积和稀释介质密度微小的变化都会影响最终结果。要想知道Percoll溶液最后的实际密度,建议使用密度计或折射计来测定。
注意:用0.15 M生理溶液或0.25 M蔗糖稀释SIP后的溶液密度也可参考图5的经验指南。该图特指SIP的稀释,其中SIP由90%(v/v)未稀释Percoll和10%(v/v)生理溶液或蔗糖混合而成。为了避免混淆,最好用工作液的实际密度(或以% SIP表示),而不是以Percoll占等渗生理溶液或蔗糖的比例来表示工作液。这一点在采用下节的一步法稀释时尤为重要,该法用蒸馏水将Percoll(未稀释)及浓缩盐或蔗糖稀释至最终体积,来获得需要密度的工作液。
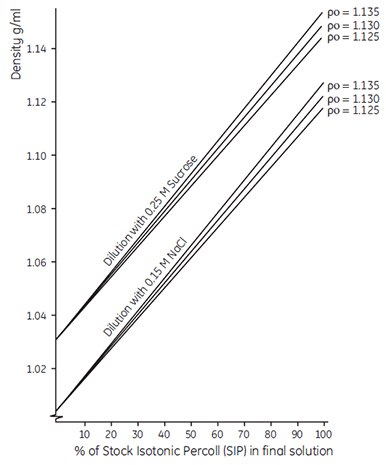
图 5.用等渗生理溶液或蔗糖溶液稀释Percoll等渗母液(SIP)。Po为Percoll(未稀释)密度。SIP按上节制备。显示的校准线仅供参考。准确的密度测定请查阅文中公式。
一步法稀释Percoll
Percoll(未稀释)可通过下述方法直接稀释到需要密度的工作液。在量筒中加入占最终所需体积1/10的1.5 M NaCl或2.5 M蔗糖(例如,配制100 mL工作液需加10 mL)。按照下式计算,继续加入所需体积的Percoll(未稀释)。用蒸馏水定容至最终体积。
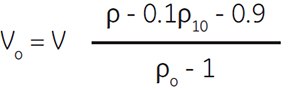
式中:
Vo = Percoll(未稀释)体积 (mL)
V = 工作液体积(mL)
ρ = 工作液需要密度(g/mL)
ρo = Percoll(未稀释)密度(g/mL)
(准确密度参见CoA)
ρ10 = 1.5 M NaCl密度 = 1.058 (g/mL)
(其他盐类略有差别)
2.5 M蔗糖密度 = 1.316 (g/mL)
(其他添加剂略有差别)
举例:用0.15 M NaCl配制1.07 g/mL的100 mL Percoll工作液时,加入10 mL 1.5 M NaCl,需加入
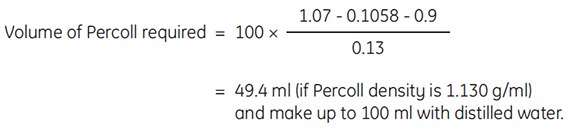
以上公式获得的密度仅仅与需要密度非常接近,但并不能保证完全相同,因为加入体积和稀释介质密度微小的变化都会影响最终结果。要想知道Percoll溶液最后的实际密度,建议使用密度计或折射计来测定。
Percoll(未稀释)体积与最终密度的关系图与图5类似。
稀释Percoll到需要渗透压
配制适合大多数哺乳动物细胞使用的等渗Percoll溶液时,通常将9份Percoll(未稀释)用1份1.5 M NaCl或2.5 M蔗糖溶液稀释。配制的Percoll等渗溶液(SIP)可按照需要用生理溶液进一步稀释。不过,虽然实践证明此法可行,但它极度简化,并未考虑溶液中的硅胶颗粒会造成的影响(即100 mL Percoll母液含有一定量的固体硅胶,使实际的水相总体积低于100 mL)。由于硅胶占去体积,使母液电解质的有效浓度超过生理盐溶液,配制的SIP会呈高渗状态。因此,一般建议要测定SIP的实际渗透压。
Vincent和Nadeau(555)妥善解决了该问题,并提供公式计算1份10×生理盐水浓缩液应加入多少份Percoll,才能获得需要渗透压的SIP。他们先计算Percoll母液中硅胶的体积分数,据此推算水相溶液在Percoll母液中的体积比。
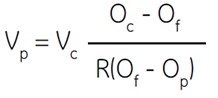
式中:
Vp = Percoll待加份数
Vc = 溶质浓缩液待加份数(例如,1.5 M)
Oc = 溶质浓缩液渗透压(例如,1.5 M NaCl = 2880 mOsm)
Of = 需要渗透压
R = 水相体积占Percoll总体积的比例(一般 NaCl为0.85,蔗糖为0.80)
Op = 未稀释Percoll渗透压(CoA)
该等式中的关键参数是R,用于衡量Percoll溶液中的实际水相体积。R值随Percoll颗粒的水动力学体积而变,后者则受介质离子强度的影响,即水动力学体积随着离子强度增加而减小。因此,1.5 M NaCl和2.5 M蔗糖的R值并不相同。
用1.5 M NaCl(10倍浓缩的生理盐水)获得渗透压 = 320 mOsm/kg H2O的SIP:
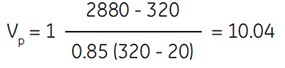
设:
2880 = 1.5 M NaCl渗透压
(10×浓缩生理盐水)
20 = 未稀释Percoll渗透压
因此,为了获得320 mOsm/kg H2O的SIP,应取10份Percoll与1份1.5 M NaCl混合。
渗透压对细胞和亚细胞颗粒表观浮力密度的影响
Percoll产生的渗透压很小,因此适合用于研究分离介质渗透压与颗粒表观浮力密度的相互关系。如图6所示,渗透压200、300、400 mOsm/kg H2O对大鼠肝细胞在Percoll梯度中的区带影响。随着渗透压的增加,由于细胞失水,细胞的表观浮力密度也随之增大。线粒体(图7)和溶酶体(表1)也表现相同效应,即使很小的渗透压变化也会引起这些细胞器较大的表观浮力密度变化。因此,相比在蔗糖等离心介质形成的梯度区带中的浮力密度,在生理渗透压的Percoll梯度区带中的颗粒的实际浮力密度与体内情况更加接近。
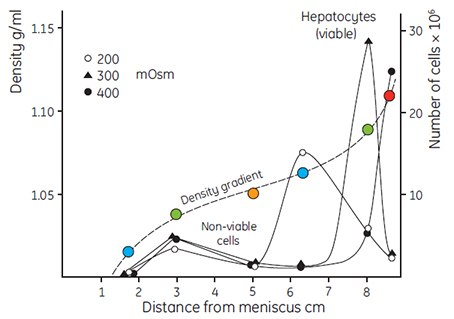
图 6.大鼠肝细胞(35 × 106个细胞,2 mL)在自然形成的Percoll梯度液(8 mL溶液,密度1.065 g/mL)中的分级分离。用NaCl将Percoll溶液的渗透压调为200 mOsm、300 mOsm、400 mOsm。使用贝克曼转头30.2在4 °C、35 000 × g下离心15 min。采用密度标记珠(Density Marker Beads)测定密度梯度(参见原文档第23页)(27,图像复制经过作者和出版商允许)。
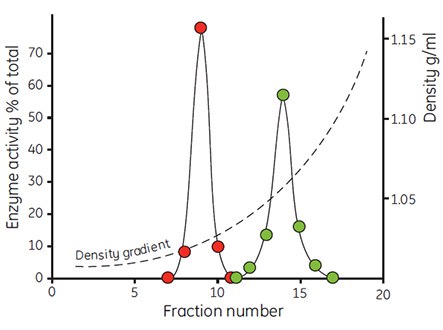
图 7.大鼠肝细胞线粒体经过等渗缓冲液(红)和含17.5%缓冲液(绿)孵育后的密度分布。使用贝克曼转头65(23°角)在40 000 × g 下离心30 min(59,图像复制经过作者和出版商允许)。
回收Percoll/0.25 M蔗糖梯度在1.0-1.05 g/mL密度范围内的大鼠肝细胞溶酶体,用上表所述介质37 °C孵育1 h。在Percoll/0.25 M蔗糖梯度中再次测定浮力密度(27,图像复制经过作者和出版商允许)。
梯度形成和形状的影响因素
虽然Percoll颗粒的含水体积在0.15 M NaCl中比在0.25 M蔗糖中小,但由于Percoll在盐溶液中的粘度更低,颗粒的沉降速率更快。因此,用终浓度为0.15 M生理盐水或离子强度相当的组织培养基制备的Percoll等渗液,自然形成梯度的速度比用终浓度为0.25 M蔗糖制备的相当的Percoll等渗液快2-3倍。
离心力和时间是相关的,即总的(离心力)×(时间)决定了梯度的形状。为了在角转头离心中自然形成梯度,0.15 M生理盐水的Percoll要求最低离心力约10 000 × g,0.25 M蔗糖的约25 000 × g。如图8所示,相同条件下不同的转头角度对梯度的形状有明显的影响。随着转头角度逐渐竖直,形成梯度的路径变得更短且梯度形成更快。图9和图10说明Percoll的起始浓度对梯度形状也有影响。
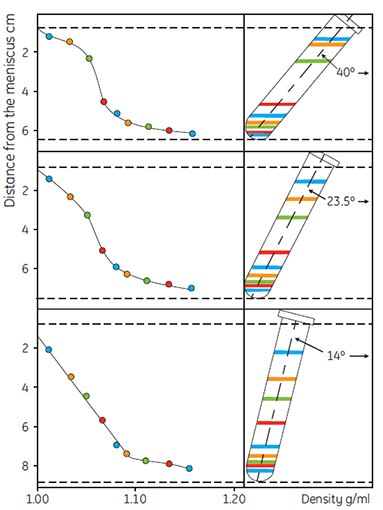
图 8.转头角度对Percoll梯度的影响。起始密度为1.065g/ml(0.15 M NaCl)。运行条件:30 000 × g,14 分钟。彩色线条代表彩色密度标记珠(Density Marker Beads)的位置(45,图像复制经过作者和出版商允许)。
垂直转头离心可极其快速地形成Percoll梯度。不过需要特别注意,在高速离心下可能更加紧密的Percoll颗粒容易污染分离中的梯度。
由于较长的路线长度和沿着管壁的不平衡的离心力,自然形成梯度时不推荐使用吊桶式转头。但Jenkins等人(个人通讯,参考文献87)报道了使用这类型转头进行肝脏细胞器亚细胞分离的一些优点。
区带转头可在原位形成Percoll梯度。区带转头梯度与角转头梯度的特征相同。由于这种转头耗用的样品体积较大,推荐先通过非区带转头实验确定梯度分离条件后再放大为区带转头。区带转头已用于大规模的病毒纯化(21)和溶酶体的亚分离(24)。
在开始梯度自成实验前,最好先用彩色密度标记珠(第22页)进行模拟实验,按照角转头离心条件制作标准曲线,以供后续实验使用。
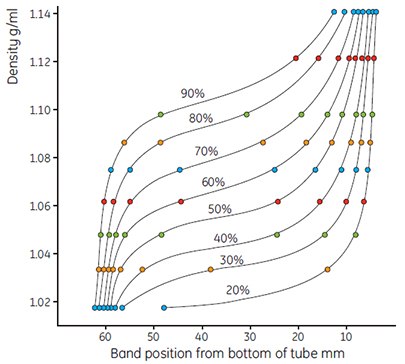
图 9.使用彩色密度标记珠显示梯度形状。结果表明,不同浓度的Percoll溶液(0.15 M NaCl稀释的20%-90% Percoll等渗母液)形成的梯度形状各不相同。运行条件:23°角转头,30 000 × g,15 min。
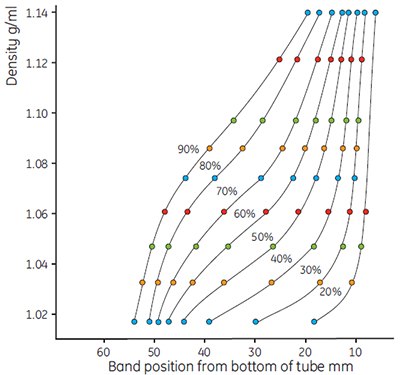
图 10.使用彩色密度标记珠显示梯度形状。如图9所示稀释Percoll,运行条件:23°角转头,60 000 × g,15 min。离心力加大后,形成的梯度更为陡峭。
不连续(阶梯形)梯度
不连续梯度非常灵活且使用方便。通常,一层Percoll或一个阶梯就能出色地富集或分离一种目标细胞。例如,通过不连续梯度能富集大多数血细胞(图11)。
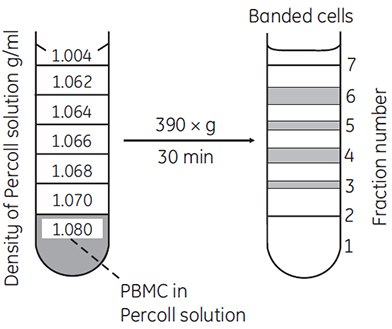
图 11.通过Percoll不连续密度梯度离心法分离淋巴细胞与单核细胞。将Ficoll-Paque™分离的1.5-2.0 × 107 PBMC(外周血单个核细胞)混合11.25 mL Percoll(含1% HEPES缓冲液的Hanks平衡盐溶液稀释)(密度 = 1.080 g/mL),置于图示梯度液下方(69,图像引用经过作者和出版商允许)。
制备不连续密度梯度时,先按第12页所述将SIP(Percoll等渗母液)稀释为一系列的不同密度。接着按先浓后稀的顺序,小心地逐层铺设不同密度的溶液。加液时最好使用移液器或大孔针头的注射器。切记要保持装置尖端紧靠管壁和液面上方,防止液体“飞溅”和界面搅混。细胞在交界面上形成锐利区带仅在密度梯度有急剧改变时才发生。
使用相对温和的条件进行离心,例如用台式离心机400 × g离心15到20分钟。这些温和条件使细胞在对应的交界面上形成等密度条带。低离心力(g)和短离心时间将不会引起Percoll的沉降且不会以任何方式影响梯度。
连续线性和非线性梯度
连续密度梯度的特点是从管的顶层到底部的密度连续改变。不同于不连续梯度的明显交界面,连续梯度可视为拥有无数的交界面。因此,细胞会刚好在细胞本身密度处形成等密度条带。
制作这种梯度时,先将SIP稀释为所需密度范围两端的浓、稀两种溶液,接着用双室梯度混合器混合,形成两端之间的线性梯度。
组合单通道蠕动泵和梯度混合器可制作直线、凸形、凹形梯度,具体取决于管子的相对直径。当从顶层到底部形成范围很窄的梯度时,活细胞分离可实现最大分辨率。比较重的细胞通常会沉淀,死细胞则位于梯度液顶层。例如,底部梯度层的密度不超过1.08 g/mL时,红细胞会沉淀。可在与样品管相同梯度的管中加入密度标记珠(Density Marker Beads)作为外部对照标记物。
连续梯度实现分离的离心条件同不连续梯度。连续梯度的分离实例包括Leydig细胞、催乳素细胞(lactotroph)、骨髓细胞、肠道上皮细胞、海洋微藻和叶绿体的纯化。
预制自成梯度
通过离心预先形成梯度是可以替代梯度形成仪或泵使用的方便做法。如前所述,施加较大离心力(> 10 000 × g)后Percoll会开始沉降形成梯度。预制梯度时,先将SIP稀释到实现最大分辨率需要密度范围的中间密度。将梯度材料装备2个离心管,1管用于实验,第2管加密度标记珠。第2管既可以作为平衡管又可以作为监测梯度的外部方法。两管用角转头离心(例如,30 000 × g,15 min),从起始密度开始形成等密度梯度(图4)。相对“平缓”的梯度区域应包含获得最大靶细胞分辨率需要的密度范围,查看密度标记珠管的梯度形状可确认这一点。随着离心时间的增加,梯度逐渐变得更加陡峭。已证明,梯度形状与离心力和离心时间的总体成近似线性相关。
形成梯度后,细胞400 × g低速离心15-20 min可获得等密度条带。需要估计细胞密度时,可取另一离心管将与细胞悬液等体积的密度标记珠悬液铺到管顶层。该管既能估算细胞密度,也能用于配平。
原位形成梯度
亚细胞颗粒和病毒的沉降系数通常太低以至于在低离心力下无法在预制梯度中形成条带。因此,通常比较方便的做法是将生物颗粒悬液与Percoll混合,颗粒随着原位(in situ)形成的梯度而分离。通过离心形成的Percoll梯度是亚稳定的(即它们在高速离心时将不断地改变),Percoll溶胶的沉降速率缓慢,足以让“S”值大于60S的小病毒和细胞器随着原位形成的梯度而分层。
原位形成梯度的常规方法是先制备SIP,即将9份Percoll与1份2.5 M蔗糖混合,接着用0.25 M蔗糖稀释SIP到需要密度(虽然原位梯度常使用蔗糖,但也可以使用细胞培养基)。将样品与梯度材料直接混合后,对Percoll溶液整体密度的影响可以通过13页的公式计算。预先混合样品与梯度材料可便于准确测定颗粒的浮力密度。不过,最好是将样品铺在梯度材料的顶层,特别是需要将亚细胞颗粒与可溶性蛋白分离时。这时可溶性蛋白将停留在梯度上方的缓冲液层中,而亚细胞颗粒将随着原位Percoll梯度分离。
离心必须在角转头中进行。在平衡管中用密度标记珠替代实验样品作为平行对照,可用于监测梯度。如22页所述,在正式实验前,可先进行适当的模拟实验,确定待用转头的梯度形成特征。
Percoll梯度的最大上样量
在Percoll梯度上能够分离的细胞或亚细胞的最大量并没有任何标准。对于亚细胞分离,10 mL梯度材料配0.5 mL含1-5 mg蛋白的样品能够成功实现纯化(Pertoft,个人通讯)。
模拟实验实现Percoll梯度条件的标准化
离心形成梯度的具体形状和范围受转头的样式和角度、还有离心管大小的影响。下列实验专门设计用于建立特定转头和离心管的一系列梯度曲线,可作为后续所有实验的参考。
示例为10 mL梯度,不过可以放大到更大的离心管。
- 混合49.5 mL Percoll和5.5 mL 1.5 M NaCl,配成SIP。
- 如下表所示,用0.15 M NaCl混合第一步中的SIP,制备一系列10 mL实验样品(离心管总大小 = 13.5 mL):
- 根据包装中提供的说明书,每管加10 μL每种密度标记珠悬液。
- 平衡并盖上管子,上下颠倒数次混匀。
- 将管子放置在角转头中(如果只有8个空位,省略1号和10号)。
- 30 000 × g离心15 min。
- 小心取出管子,用毫米方格纸测量(精确到0.5 mm)每条区带距离管底的距离。
- 按每种标记珠的准确浮力密度校准每条区带,绘制每管的梯度形状。
- 上下颠倒重新混匀各管内容物,60 000 × g再次离心15 min。
- 如上测量梯度和绘制结果。应用公式(见13页)计算稀释液的准确密度。图9和图10的典型例子是Percoll/0.15 M NaCl的一系列曲线。
也可采用Percoll/0.25 M蔗糖重复实验。这种情况的运行条件应为50 000 × g离心25分钟后再100 000 × g离心25分钟。
使用离心力计算器,可将每分钟转速(RPM)转换为相对离心力(RCF或g force)。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?