诱导多能干细胞重编程实验方案
简介
方法
使用非整合的自我复制RNA载体重编程人成纤维细胞
使用STEMCCA慢病毒载体重编程外周血单个核细胞(PBMC)
重编程iPSC集落的表征和拣选
常问问题
材料
简介
诱导多能干细胞(iPSC)的现成来源对于分化途径的有效研究以及iPS细胞的治疗潜力的研究是至关重要的。自从发现通过诱导四种重编程因子(OCT-4、SOX-2、KLF-4和c-MYC)的表达可以产生人类iPSC之后1,出现了许多不同的生成iPSC的重编程技术,每种都具有自身优点和缺点2。
基于逆转录病毒和慢病毒系统的第一代技术实现了高效的重编程事件,但缺乏对宿主基因组整合的必要控制。Cre可切除的慢病毒系统提供了基因组整合的解决方案,但需要冗长的亚克隆程序和筛选以确保切除重编程因子。
第二代技术使用非整合游离DNA质粒,这些质粒不含转基因,但缺乏早期逆转录病毒和慢病毒技术的重编程高效率。第三代技术使用负义、非整合RNA病毒,称为仙台病毒(SeV),其源自于小鼠、仓鼠、豚鼠、大鼠和猪的高度传染性呼吸道感染。这些RNA病毒产生无整合的iPSC,且重编程效率高,易于使用,但残留的仙台病毒难以从细胞中清除,导致需要多轮克隆扩增和分析。
使用专门设计的合成的自我复制RNA模拟细胞RNA的下一代重编程系统已被用于产生人iPS细胞3。单个RNA链含有四个重编程因子,使用单个转染步骤即可实现极其有效的重编程,而无需任何病毒中间体或宿主基因组整合。产生iPSC后,通过从细胞培养基中除去干扰素-γ(IFNg)抑制剂B18R,即可容易地选择性地消除RNA。
浏览所有多能干细胞产品
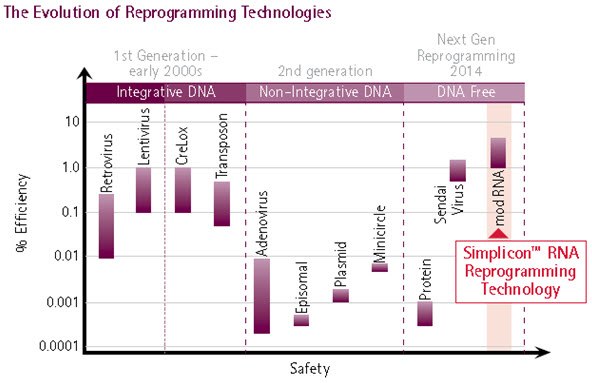
图 1.重编程方法的演变。重编程技术的演变,最终导致开发出合成RNA介导的重编程(最右边),它代表了最安全和最有效的iPS细胞生成方法:Simplicon™ RNA重编程技术将逆转录病毒和慢病毒重编程技术的效率与基于非病毒的重编程方法的安全性融为一体。
图 2.Simplicon RNA人HFF重编程时间表。使用自我复制RNA的单次转染可以在执行3-4周的实验方案后产生大量无整合的iPSC。
开始实验之前:
- 确定靶标人成纤维细胞(SCC058)的最佳接种密度。最佳接种密度定义为,为使细胞在接下来的一天(第1天)达到60-80%汇合度,在第0天应该接种的细胞数。在6孔板上的成纤维细胞培养基(SCM044)中,在一系列孔中每孔接种1 x 105至1 x 106细胞。
- 确定嘌呤霉素(P8833)的最佳起始浓度。嘌呤霉素最佳起始浓度定义为,截止第4-5天达到50%细胞死亡所需浓度的一半。嘌呤霉素的敏感性会随靶细胞系的不同而改变,在开始前必须先凭经验确定。
重编程实验方案
第0天接种靶细胞
- 以最佳接种密度(在步骤1中确定)接种靶细胞,所使用的培养基与维持靶细胞于增殖状态所使用的培养基相同。6孔板每孔体积应为3 mL。留出一个孔作为未转染的对照孔,用以观察嘌呤霉素细胞死亡情况。
- 在冰上解冻以下Simplicon RNA重编程试剂盒(SCR550)组分,并等分到无菌无核酸酶的Eppendorf管中。储存在-80 °C下直至准备使用。
• VEE-OKS-iG RNA:将3μL等分到无菌无核酸酶的eppendorf管中。将等分试样储存在-80 °C下。
• B18R RNA:将3μL等分到无菌无核酸酶的eppendorf管中。将等分试样储存在-80 °C下。
• B18R蛋白:将3μL等分到无菌无核酸酶的eppendorf管中。将等分试样储存在-80°C下。
第1天:用B18R蛋白质预处理细胞,用Simplicon™ VEE-OKS-iG和B18R RNA转染。
- 在转染当天,细胞应该是60-80%汇合。用200 ng/mL B18R蛋白(GF156)在1 mL/孔DMEM(SLM-120-B)中预处理靶细胞2小时,以帮助在用SimpliconTM RNA转染之前抑制细胞干扰素反应。
- 在250 ul Opti-MEM培养基中加入0.5 ul VEE-OKS-iG和B18R RNA以及4.0 ul RiboJuice™ mRNA转染试剂(TR-1013),以制备RNA / 转染复合物。将RNA / 转染试剂复合物逐滴添加到含细胞6孔板的一个孔中,通过摇动混合,并将板在37℃、5% CO2培养箱中孵育4小时。
- 4小时后,用DMEM (SLM-120-B)、10% FBS(ES-009-B)、1X谷氨酰胺(A8185)和200 ng/mL B18R蛋白(GF156)补充培养基,在37℃、5% CO2培养箱中孵育。
第2天-11天:应用最佳起始浓度的嘌呤霉素
- 吸除培养基。用2 mL含有200 ng/mL B18R蛋白质的FBS培养基替换(参见配制步骤7)。加入在步骤2确定的最佳起始浓度的嘌呤霉素(P8833)。从一侧到另一侧轻轻摇动平板,使嘌呤霉素与培养基充分混合。
- 每天用2 mL含有200 ng/mL B18R蛋白质和新鲜嘌呤霉素的第1阶段培养基更换培养基。
注意:每天监测以评估细胞对嘌呤霉素的反应。
- 到第4-5天,可观察到不同程度的细胞死亡。调整嘌呤霉素浓度,以使30-60%的细胞死亡。保持这种浓度直至第11天。
第11-18天:重新接种重编程细胞,扩增iPSC
- 当具有嘌呤霉素抗性的细胞在第11天左右达到70-90%汇合度时,可以将它们重新接种到基质胶包被的平板上(以进行无滋养层细胞培养)或灭活的MEF滋养层上(以进行有滋养层细胞培养)。这可能在第9-18天之间的任何时间发生,取决于细胞对嘌呤霉素的反应。建议的扩增培养基包括:MEFCM(SCM103)、10 ng/mL bFGF(GF003)、1X人iPSC重编程增强补剂 II(SCM094)和200 ng/mL B18R蛋白质(GF156)。
第18-30天:iPSC集落的采摘和扩增。
- 继续每天监测人iPSC集落的生长情况。寻找紧实且具有明确边界的均匀菌落。当iPSC集落达到大约200个细胞或更大尺寸时,即可采摘,用于在无滋养层PluriSTEM 人 ES / iPSC培养基(SCM130)中进行扩增,供进一步实验使用。
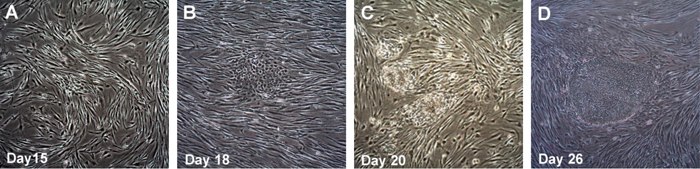
图 3.使用人Simplicon RNA重编程试剂盒产生人iPSC集落的时间过程。在第10天,将转染的HFF重新接种到无活性的MEF上,从第15-16天开始出现集落,并且在第17-20天左右更明显(A、B)。在第26天即可采摘集落。
使用STEMCCA慢病毒载体重编程外周血单个核细胞(PBMC)
第0天外周血单个核细胞(PBMC)的分离和扩增。
- 将4 mL外周血吸入含有柠檬酸钠的BD Vacutainer CPT细胞制备管中。将管上下倒置8至10次,并在室温下以1,800 × g离心30分钟。此步骤最好在收集后2小时内进行。
- 将血沉棕黄层(凝胶屏障与血浆之间的细胞层)移液到无菌的15 mL锥形离心管中,以收集单个核细胞(MC)。用无菌磷酸盐缓冲盐水(D8537)将总体积定容至10 mL,上下倒置数次,然后以300 × g离心15分钟。
- 将细胞重悬于10 mL无菌PBS(D8537)中,并进行细胞计数。将1至2×106个细胞转移至无菌的15 mL锥形离心管中,并以300 × g离心10分钟。
- 将细胞重悬于2 mL扩增培养基(EM)中(QBSF-60干细胞培养基,含50 μg/mL抗坏血酸(A4403)、50 ng/mL SCF(S7901)、10 ng/mL IL-3(I1646)、2 U/mL EPO(H5166)、40 ng/mL IGF-1(I3769)、1 μM地塞米松(D4902)和1% Pen/Strep(P4333)),并转移至12孔板的一个孔中。将细胞置于37℃、5% CO2培养箱中孵育。
- 将剩余的细胞以300 × g离心10分钟,并在含有10% DMSO(D2650)的FBS中冷冻,~2×106个细胞/小管。
- 如果使用冷冻PBMC开始执行实验方案,则将1小管细胞解冻到10 mL QBSF培养基中,并以300 × g离心10分钟。将细胞重悬于2 mL EM中,然后转移至12孔板的一个孔中。将细胞置于37℃、5% CO2培养箱中孵育。
第3天和第6天
- 将细胞转移到无菌的15 mL锥形管中,用1 mL QBSF-60干细胞培养基洗涤该孔一次,以收集贴壁细胞。
- 将细胞以300 × g离心10分钟。
- 将细胞重悬于2 mL EM中,然后转移至12孔板的一个孔中。将细胞置于37℃、5% CO2培养箱中孵育。
第9天用STEMCCA慢病毒转导PBMC。
- 将细胞转移到无菌的15 mL锥形管中,用1 mL QBSF-60干细胞培养基洗涤该孔一次,以收集贴壁细胞。
- 将细胞以300 × g离心10分钟。
- 将细胞重悬于1 mL含有5 μg/mL聚凝胺(TR-1003)和STEMCCA慢病毒(SCR544)(MOI = 1至10)的新鲜EM中,并转移至12孔板的一个孔中。
- 在25℃下以2,250 rpm旋转板90分钟。
- 旋转后,再加入1 mL含有5 μg/mL聚凝胺的新鲜EM,使培养基总体积为2 mL,然后将培养板置于37℃、5% CO2培养箱中孵育。
第10天
- 将细胞转移到无菌的15 mL锥形管中,用1 mL QBSF-60干细胞培养基洗涤该孔一次,以收集贴壁细胞。
- 将细胞以300 × g离心10分钟。
第11天:将iPSC接种到MEF
- 用0.1%明胶(ES-006)包被6孔板的每个孔,将灭活的小鼠胚胎成纤维细胞(MEFs)接种到含有MEF培养基的孔中,2×105个细胞/孔。
- 第二天,将iPSC转移至无菌的15 mL锥形管中,用1 mL QBSF-60干细胞培养基洗涤孔一次,以收集贴壁细胞。
- 将细胞重悬于3 mL MEF培养基中,培养基含有10 ng/mL bFGF(F0291)、50 μg/mL抗坏血酸(A4403)、50 ng/mL SCF(S7901)、10 ng/mL IL-3(I1646)、2 U/mL EPO(H5166)、40 ng/mL IGF-1(I3769)、1 μM地塞米松(D4902)和1% Pen/Strep(P4333)。
- 在含有MEF的6孔板的每个孔中接种1 mL的细胞。加入1.5 mL含有bFGF、抗坏血酸和生长因子的MEF培养基,每孔培养基定容为2.5 mL。
- 在25℃下以500 rpm旋转板30分钟,将板置于37°C、5% CO2培养箱中孵育。
- 每隔一天用2.5 mL MEF培养基饲喂细胞,培养基含有10 ng/mL bFGF和50 μg/mL抗坏血酸(无生长因子)。每次饲喂时,吸除并丢弃漂浮的细胞。根据需要添加MEF。
- 在第18-21天左右,即可采摘重新编程的iPSC集落,并可用于在无滋养层PluriSTEM 人 ES / iPSC培养基(SCM130)中进行扩增,供进一步实验使用。
重编程iPSC集落的表征和拣选
最近的研究结果表明,完全重编程的人iPS细胞具有以下特征:(1)它们下调成纤维细胞标记物CD13的表达;(2)它们上调多能标记物SSEA-4和TRA-1-60的表达;(3)它们抑制病毒转基因,与此同时(4)重新激活Nanog的内源性表达;(5)它们呈现HoeschstDim表型。这些特征使得能够从部分重编程细胞的混合群体中可靠地鉴定和拣选出完全重编程的人iPS细胞。
密理博的人iPS选择试剂盒(SCR502)是一种快速、简便且无创的方法,可使用免疫细胞化学(ICC)监测完全重编程的人iPS细胞的多能状态。使用人iPS选择试剂盒可进行活细胞成像,及从异质的重编程中间体群体中鉴别出完全重编程的人iPS细胞,并且能够选择出可以进一步传代和扩增用于下游应用的人iPS细胞。
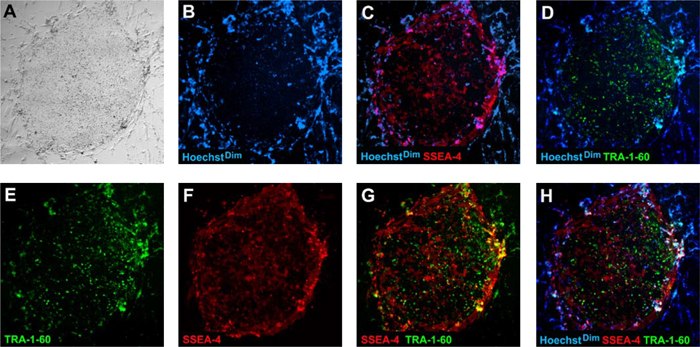
图 4.完全重编程的人iPS细胞表达人多能标记物TRA-1-60 FITC(D、E、G、H,绿色)和SSEA-4 PE(C、F、G、H,红色),同时下调成纤维细胞标记物CD13 PE(数据未显示)。图中细胞是用可渗透细胞的Hoechst核染料(B、C、D、H,蓝色)染色。完全重编程的人iPS细胞表现出Hoechst暗淡表型(参见B、C、D、H中的集落中心),而非iPS和分化细胞则表现出Hoechst亮表型(参见B、C、D、H中集落的外围,它被成纤维细胞包围,并且Hoechst染色明亮)。第5代人iPS集落用于活染色。
常问问题解答
- Simplicon可以用来重编程PBMC吗?
不可以,效率太低。
- 即使已含有B18R蛋白质,我是否需要转染B18R RNA?
我们凭经验发现,与使用VEE-OKS-iG RNA和B18R蛋白质相比,在B18R蛋白质存在下共转染VEE-OKS-iG和B18R mRNA可提高重编程效率。
- 是否有必要在人iPS重编程增强补剂 II 中添加小分子?
不需要,然而,小分子可显著提高集落形成的效率和质量。
- 我可以多次转染RNA或用慢病毒转导吗? 这样做会提高重编程效率吗?
根据我们对人包皮成纤维细胞的经验,单次转染就足够了。 RNA自我复制和嘌呤霉素抗性基因将帮助选择摄取自我复制RNA的细胞。对于其他细胞类型,额外的转染或病毒转导可能有帮助,但应在重新接种前进行。
- RNA在细胞中会自我复制多长时间?
基于PCR数据,p4中已不存在RNA。
- 重新接种后是否需要使用MEF-CM?还是可以使用另一种人类ES/iPS培养基?
可以使用PluriSTEM培养基(SCM130)等其他培养基,但为了获得最佳效果,建议使用MEFCM。
- 是否需要将转染后的细胞重新接种到MEF滋养层?
转染后的细胞可以重新接种到含有B18R蛋白质的第2阶段培养基的MEF滋养层或基质胶包被的平板上。 当开始出现微小的iPS集落时,可以撤出B18R蛋白质。
- 在重新接种期间是否应该使用Rock抑制剂来增加细胞存活率?
不需要Rock抑制剂。
- 如何从宿主基因组中去除STEMCCA转基因?
STEMCCA包含侧面连接Yamanaka因子的LOXP位点。重编程后,可以用CRE-重组酶(SCR508)处理iPSC细胞以除去转基因。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?