mRNA 疫苗和疗法的生产策略
随着 mRNA 疫苗的早期成功,如今的 mRNA 制造商正寻求通过提高 mRNA 的稳定性、实施改进 pDNA 和 mRNA 纯化的策略以及扩大 GMP 生产规模来提高生产流程的效率和生产力。
查看我们为mRNA开发和制造提供的所有产品和服务。
部分概述
mRNA制造的考虑因素
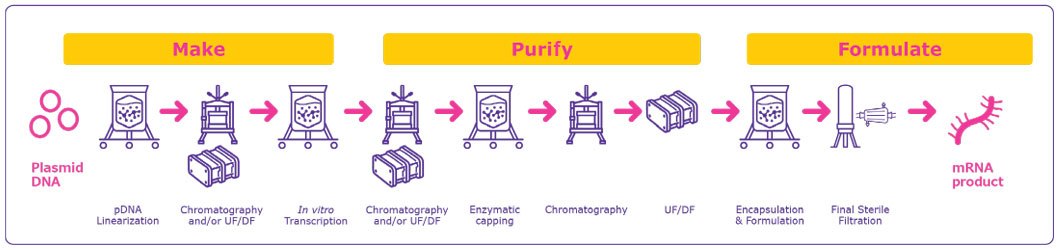
mRNA 疫苗和疗法的生产通常遵循模板化流程(图 1)。这种简化的生产模板对任何靶点都使用相同的反应材料,使 mRNA 制造商只需进行最小的工艺调整就能生产出新的靶点分子。
有几项关键决定对最终 mRNA 产品的工艺、产量和质量有着重大影响,其中之一就是工艺化学品和原材料的质量。特别是在体外转录和下游纯化过程中,mRNA 不受保护,极易发生酶降解。使用经过无内切酶活性测试的高质量化学品,可将 RNase 引起的降解风险降至最低,并在 mRNA 药物产品的整个纯化和配制过程中提高 mRNA 的稳定性。
本网页将通过提供有关我们旨在简化 mRNA 生产的全面综合解决方案的信息,帮助您应对这些挑战和其他挑战。我们的手册"用于 mRNA 药物生产的工艺化学品"提供了您做出明智选择所需的详细信息。
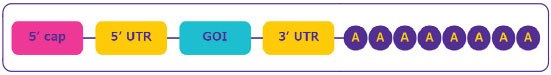
图 2.mRNA 结构。
- 序列 5' 端的帽区:对于 mRNA 的成熟、核糖体的识别以实现高效蛋白质翻译以及防止核酸酶消化以提高稳定性至关重要。
- 位于 mRNA 编码区上游和下游的非翻译区 (UTR):调节 mRNA 的翻译、定位和稳定性;可用于提高蛋白质的表达效率。
- 开放阅读框或编码序列区:包含相关基因(GOI)。
- 聚(A)尾:通过防止 3' 外切酶的消化,对蛋白质翻译和 mRNA 稳定性至关重要。
Making mRNA
基于 mRNA 的疗法和疫苗的生产从质粒 DNA (pDNA) 模板开始,然后将其线性化并转录为 mRNA。
- pDNA生产:pDNA模板包含DNA依赖性RNA聚合酶启动子和mRNA构建体的序列。pDNA 在细菌细胞中扩增,然后收获并裂解,释放出环状 pDNA。这种裂解液非常粘稠,因为它含有 pDNA 和其他大量带负电荷的杂质,如来自细菌细胞的 RNA、基因组 DNA 和内毒素,这就给纯化工作带来了挑战。1线性化的 pDNA 模板需要进一步纯化,以去除杂质,如用于线性化的限制性酶、牛血清白蛋白 (BSA)、DNA 片段和内毒素。由于 pDNA 模板通常是在细菌细胞中产生的,因此内毒素杂质是影响后续纯化步骤的关键杂质。Deviron® C16洗涤剂等洗涤剂可用于有效去除内毒素,是一种可持续、可生物降解且符合REACH标准的传统洗涤剂替代品。2
实验室规模和 GMP 生产规模的 pDNA 纯化方法存在明显差异。实验室规模的工艺通常使用溶剂萃取技术将 pDNA 从其他成分中分离出来,但大规模处理和处置这些化学物质具有挑战性。相比之下,GMP 生产环境通常使用切向流过滤 (TFF) 和色谱法来有效去除杂质。
体外转录 (IVT):线性化和纯化的 pDNA 然后在酶促反应中转录成 mRNA。
- 体外转录的关键部件包括 RNA 聚合酶,它催化 DNA 转录为 mRNA;核糖核苷三磷酸酶(rNTPs)是 mRNA 的组成成分;无机焦磷酸酶(IPP)可提高 mRNA 的产量;RNase 抑制剂可防止 RNA 降解。转录缓冲液通常含有dithiothreitol (DTT),用于减少二硫键和抑制 RNase 活性,而则用于提高转录效率和稳定核酸。为了最大限度地降低这一关键工艺步骤中的酶降解风险,必须选择经测试不含内切酶活性的化学品。如需全面了解我们的优质化学品和辅料,包括广泛的不含内切酶的产品组合,请查阅我们的手册"用于 mRNA 药物生产的工艺化学品"。
- 转录监控:在 IVT 反应期间应监控关键工艺参数 (CPP),以控制关键质量属性 (CQA),确保最佳加工过程。有效的监控可使生产过程更加受控,并对过程变异做出更快的反应。
加帽:转录后,mRNA 转录本上要加上 5' 帽结构,以提高稳定性和在宿主细胞中的转导能力。加帽有两种方式:
- 共转录加帽:在 IVT 步骤中进行。然而,这种方法的效率和产量较低,而且由于错误结合或反向掺入,可能会产生非加帽杂质。
- 酶法加帽(或翻译后加帽)在 mRNA 纯化后进行。这种方法通常使用加盖酶将盖添加到纯化的 mRNA 中。虽然这种方法更有效,但成本较高,而且是纯化后的额外处理步骤。
纯化mRNA
在体外转录后转录后,mRNA 将从杂质和前面步骤中使用的材料(包括内毒素、免疫原性双链 RNA (dsRNA)、残留 DNA 模板、RNA 聚合酶和元素杂质)中纯化出来。mRNA 纯化和去除残留 DNA。
色谱分离,如反相离子对(IPPR)、阴离子交换(AEX)。和使用 poly(dT) 捕获的亲和层析 (AC) 技术(图 3)可有效纯化 mRNA 目标并去除 DNA 模板,从而无需进行 DNA 消化1, 3。色谱法还可在酶封后用于去除不需要的 mRNA 转录本和寡核苷酸杂质。

图 3:比较反相离子对色谱、阴离子交换色谱和亲和色谱在 mRNA 纯化中的应用(DBC:动态结合能力)4,5。
- 反相离子配对(IPPR)可用于小规模高效捕获目标单链 RNA (ssRNA),并将其与杂质分离。
- 阴离子交换(AEX)色谱法具有很高的动态结合能力,能有效去除dsRNA、未封端 RNA、RNA-DNA 杂交体和发夹 mRNA 等其他 RNA 结构中的杂质。
- 亲和层析(AC)poly(dT)捕获使用一种树脂来特异性捕获全长 mRNA 转录本的 poly(A) 尾。这种方法能有效去除 DNA、核苷酸、酶、缓冲液成分和任何其他没有聚(A)尾的杂质。
- 在层析步骤后进行最终浓缩和重过滤,以最大限度地提高产品纯度,并将 mRNA 转移到适当的缓冲液中进行配制或储存。
Scale-up Considerations
一次性使用技术提供 可扩展性、适应性和质量,适合拥有大量靶标管线的制造商,是许多 mRNA GMP 生产工艺的关键推动因素。GMP 生产利用 TFF 或层析步骤的优势进行高效的大规模分离,取代了小规模工艺开发中典型的替代纯化方法。需要注意的事项包括:
- TFF或层析步骤取代了 mRNA 工艺开发中常用的溶剂萃取和沉淀步骤。
- 必须尽可能使用高质量的化学品和不含内切酶的试剂,以提高 mRNA 的稳定性,并将 mRNA 降解的可能性降至最低。
近年来,mRNA 疫苗在向大量患者群体推广方面取得了重大成功。尽管挑战依然存在,但通过使用高质量的化学品和不含内切酶的试剂来最大限度地提高 mRNA 的稳定性,优化和定制色谱纯化技术以最大限度地提高分离度并简化放大过程,这些都使 GMP 生产模板取得了重大进展。
为确保 mRNA 技术充分发挥潜力,我们需要创新的解决方案、专业知识和聪明才智,以确保稳健的平台在生产规模上不断发展。凭借我们的产品、服务和技术专长,我们致力于开发综合解决方案,以简化您的 mRNA 生产流程。
参考资料
如要继续阅读,请登录或创建帐户。
暂无帐户?