Northern和Southern印迹实验方案及简介
Southern Blotting实验方法
Northern Blotting实验方案
什么是Northern和Southern印迹?
核酸与蛋白质等大分子向固相支撑膜的转移称为印迹。通过凝胶电泳分离的DNA和RNA分子的片段分别在称为Southern和Northern印迹的过程中转移到尼龙或硝酸纤维素膜上。Southern印迹由Edwin Southern于1975年推出,是一种检测DNA样品中特定DNA序列的方法。基于该方法出现的其他印迹技术被称为Northern印迹(用于RNA)、Western印迹(用于蛋白质)、Eastern印迹(用于翻译后蛋白质修饰)和Southwestern印迹(用于DNA-蛋白质相互作用)。
Southern和Northern印迹实验方案包括以下主要步骤:
- DNA/RNA的纯化:从细胞或组织来源中提取和纯化DNA/RNA。
- 消化DNA:用限制酶把DNA消化成片段。RNA不需要该步骤。
- 凝胶电泳:在琼脂糖凝胶上分离DNA片段。RNA样品可以在琼脂糖凝胶上用甲醛分离,甲醛作为限制RNA分子二级结构的变性剂。
- 转膜:将DNA/RNA片段从凝胶转移到尼龙膜上。
- 预杂交(封闭):用含有鲑鱼精子DNA的预杂交溶液清洗尼龙膜,以封闭非特异性DNA相互作用并降低背景噪音。亦可使用PerfectHyb™ Plus缓冲液,这种情况下不需要用鲑鱼精子DNA进行封闭。
- 探针的制备:准备新的探针DNA并用32P α标记的dCTP标记。
- 杂交:用标记的探针孵育印迹。
- 探针的检测:在-80 °C下曝光胶片,检测探针和目标DNA/RNA序列。
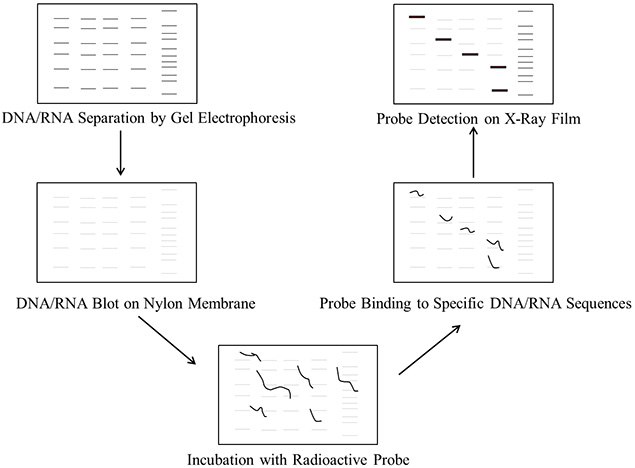
图 1.DNA/RNA印迹操作程序中的步骤
Southern印迹实验方案
所需材料
- 用于DNA分离和纯化的试剂
- 用于限制性消化DNA的试剂
- 琼脂糖凝胶电泳的试剂和缓冲液
- 琼脂糖凝胶电泳仪
- Whatman滤纸
- 纸巾
- 带正电荷的尼龙膜
- 鲑鱼精子DNA
- 杂交管
- X光胶片
所需缓冲液
- 10X TBE(93290),用于凝胶电泳。对于较大的DNA片段,可以使用TAE缓冲液(65497)代替TBE。或者使用Bionic™缓冲液(B6185)代替TAE或TBE,以在更短的时间内获得更清晰的条带。您可以使用以下试剂制备10X TBE缓冲液:
TRIS 1.3 M
硼酸 450 mM
EDTA 25 mM
- 20X SSPE(S2015),用作预杂交和转膜缓冲液。在类似的印迹实验方案中,可以使用20X SSC(93017)代替SSPE。或者您可以使用以下试剂制备20X SSPE溶液:
NaCl 2.98 M
EDTA 0.02 M
磷酸盐缓冲液(pH 7.4)0.2M
- 变性溶液(N1531),用于使dsDNA变性,以使其与探针结合。或者您可以使用以下试剂制备1X变性溶液:
NaCl 1.5 M
NaOH(S5881)0.5 N
将pH调节至~13
- 中和溶液(N6019),用于在变性dsDNA后中和凝胶。或者您可以使用以下试剂制备1X中和溶液:
NaCl 1.5 M
TRIS HCl 1M
将pH调节至7.5
- *Denhardt溶液(D2532),在预杂交过程中用于封闭非特异性DNA杂交。或者您可以使用以下试剂制备50X Denhardt溶液:
牛血清白蛋白(A7906)1%
聚蔗糖(F2637)1% 聚乙烯吡咯烷酮(PVP40)1%
将组分溶解在水中至最终体积为50 mL。过滤除菌。 - *2X预杂交溶液(P1415),用于准备探针杂交所用的膜。或者您可以使用以下试剂制备1X预杂交溶液(100 mL):
20X SSPE 30 mL
100X Denhardt溶液10 mL 10% SDS 10mL 水50 mL
- *杂交溶液(H7140),用于杂交步骤。或者您可以使用以下试剂制备杂交溶液(100 mL):
20X SSPE 30 mL
10% SDS 10 mL
水60 mL
- 1X探针缓冲液,用于探针混合物。(100μL;新鲜制备):
1 M TRIS,pH 7.6 50μL
2 M MgCl2 5μL
0.5 M DTT 10 μL
水35 μL
- 1X探针混合物(27 μL):
探针缓冲液 2.7 μL
寡核苷酸探针(0.2 μg/μL)2μL
T4磷酸核苷酸激酶(PNK)1 μL
水11.3 μL 32P-ATP 10 µL
- 6X低苛性洗涤溶液,用于去除低同源性杂交并降低背景噪音。使用以下试剂制备600 mL洗涤溶液:
20X SSPE 180 mL
10% SDS 12 mL
水408 mL
- 1X高苛性洗涤溶液,用于去除紧密同源杂交,并进一步降低背景噪音。使用以下试剂制备600 mL洗涤溶液:
20X SSPE 30 mL
10% SDS 12 mL
水558 mL
*PerfectHyb™ Plus杂交缓冲液(H7033)可用来代替Denhardt、预杂交和杂交溶液。PerfectHyb™ 缓冲液经过优化,可在短至1-2小时的杂交中产生最大信号,且背景最小。PerfectHyb™ Plus配方适用于使用任何类型的探针、以及在任何类型的膜(带正电或中性尼龙和硝酸纤维素)上进行的任何杂交实验方案。
DNA分离
Sigma-Aldrich 提供 GenElute™ 试剂盒,用于从植物和真菌 (E5038)、哺乳动物细胞或组织 (G1N70, G1N10 和 G1N350) 、以及血液(NA2010 和 NA2020)中分离 DNA。可以在这里找到使用GenElute™试剂盒进行DNA分离的详细实验方案。
此外,DNAstable® 试剂盒 (93000-001-1EA, 93021-001-1EA, 53091-016-2ML 和 93121-017-1EA)可用于DNA运输或确保DNA在室温下的储存和稳定。
限制性酶切
用适当的限制性酶在37 °C消化DNA 2-24 h。如果DNA样品是克隆衍生产物,则1-2小时的消化时间就足够了。对于基因组DNA,通常需要用过量的酶(5-10X)孵育过夜。
如有必要,使用乙醇沉淀法浓缩消化的DNA。在凝胶上分离之前,必须完全除去痕量乙醇。
凝胶电泳
在琼脂糖凝胶上溶解消化的DNA。TAE应该用于较短时间的运行(<4小时)和较大的DNA片段,而TBE应该用于较长时间的运行(> 4小时)和较小的DNA片段(<1kb)。或者使用Bionic™缓冲液(B6185)在比TAE或TBE更短的时间内获得更清晰的条带分辨率(有关更多信息,请参见Bionic™缓冲液数据)。用溴化乙锭染色凝胶,并使用UV透照仪获得凝胶图像。如果在电泳之前将溴化乙锭掺入琼脂糖中,则可以在运行后立即获得凝胶图像。
转膜
在转膜步骤中,来自电泳凝胶的DNA(或RNA)将被转移到尼龙膜上,以使探针易于杂交和检测。
- 将凝胶转移到含有变性溶液的托盘中,溶液要足以完全覆盖凝胶。用这种溶液洗涤凝胶两次,每次洗涤在摇床上持续25分钟。
- 用水冲洗凝胶两次。
- 用中和溶液洗涤凝胶两次,每次洗涤在摇床上持续15分钟。
- 用水冲洗凝胶两次。
- 用20X SSPE在摇床上洗涤凝胶30分钟。
- 在上述步骤中,准备用于转膜步骤的Whatman纸和膜。
- 切下一条尼龙膜(15356),将其浸泡在水中。切下一条比凝胶宽的Whatman纸,将其浸泡在10X SSPE缓冲液(转膜缓冲液)中。
- 切下三条几乎与凝胶大小相同的Whatman纸。
- 切下数张几乎与凝胶大小相同的纸巾。
- 在含有10X SSPE的托盘上放置一个稳定的平台。
- 在平台上放一张saran保鲜膜。在saran保鲜膜上,放一张浸有10X SSPE的Whatman纸。用玻璃棒在它们上面滚动,以把气泡撵出。确保Whatman纸的边缘接触托盘中的SSPE缓冲液。这张Whatman纸将充当芯子,将SSPE缓冲液向上吸并穿过凝胶,以在尼龙膜上沉淀DNA条带。
- 将凝胶面朝下放在湿润的Whatman纸上。将膜放在凝胶上面。用玻璃棒在它们上面滚动,以把气泡撵出。
- 在膜上放置三层Whatman纸。用玻璃棒在它们上面滚动,以把气泡撵出。
- 在这上面放一叠纸巾,然后放上重物(如玻璃板)。
- 让这个组装静置过夜,以完全转移DNA片段。将不超过15kb的DNA片段转移大约需时18小时。
- 转移完成后,将印迹放入自动设置的UV交联机中。进行UV交联以使DNA或RNA与尼龙膜共价键合,这在检测期间增强杂交信号。另一个选择是在转膜后烘干膜,这使核酸与膜之间形成非共价的半永久键合。DNA不能与硝酸纤维素膜进行UV交联,只能烘烤。
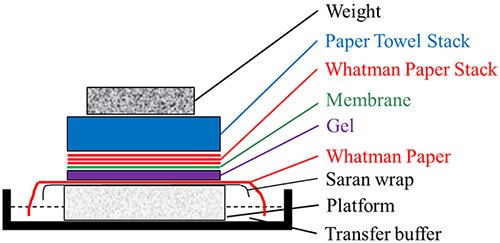
图 2.Southern/northern blot转膜组件
预杂交(封闭)
预杂交(也称为封闭)步骤的作用是最大限度地减少探针对尼龙膜的非特异性附着。鲑鱼精子DNA通常用作封闭剂,用来防止探针粘附到膜上,确保它只与已经转移到膜上的目标DNA条带相互作用。按如下步骤制备预杂交溶液或使用PerfectHyb™ Plus缓冲液(H7033):
- 将预杂交溶液加热至42 °C。
- 将鲑鱼精子DNA样本(D9156)加热至95 °C 5分钟,然后立即在冰上冷却。
- 将鲑鱼精子DNA添加到温热的预杂交溶液中,使DNA的最终浓度为50 μg/mL。
- 从UV交联机中取出印迹,并小心地将其卷入杂交管中。
- 将含有精子DNA的预杂交溶液加入杂交管中,并将其置于42 °C的杂交炉中5小时。
杂交
DNA的互补链(探针)用于检测应存在于膜上的目标序列。来自两种不同来源的DNA组合形成“杂合”dsDNA,但前提是这两条链是同源的。
- 制备1X探针混合物,在37 °C水浴中孵育40分钟。
- 让探针混合物通过G-25 Sephadex柱,以去除游离标记(未掺入的探针)。
- 用液体闪烁法确定探针的特异活性。
- 将10 mL杂交溶液加热至49 °C,向其中加入10-15 X6 cpm的探针,并充分混合。
- 将印迹中的预杂交溶液丢弃;在标记的探针中添加杂交溶液。49 °C孵育过夜。
注意:或者使用PerfectHyb™ Plus缓冲液(H7033)以更短的时间杂交,产生的信号更强。如想了解更多实验方案和数据,请参见PerfectHyb™ Plus实验方案。 - 将6X洗涤溶液温热至49 °C。将印迹中的杂交溶液丢弃,添加6X洗涤溶液。
- 将6X低苛性洗涤溶液加热至49oC。将印迹中的杂交溶液丢弃,添加6X洗涤溶液。低苛性洗涤去除低同源性杂交,以留下高同源性杂交,从而精炼目标DNA样品。
- 制备1X高苛性洗涤溶液,并将其加热至49oC。将印迹洗涤约30秒并丢弃洗涤溶液。该步骤使用高苛性溶液去除紧密同源的杂交,以进一步精炼目标DNA。
- 使用盖革计数器检查印迹的活性。如果每秒有10-50条具有照射峰值的条带,就是理想的结果。如果背景太高,则用1X洗涤溶液再次清洗印迹。
检测探针
- 将印迹放入衬有新的saran保鲜膜的暗盒中,小心地将印迹包好,确保印迹和保鲜膜之间没有气泡。
- 将暗盒放入暗室,将X光胶片放在印迹上。锁上暗盒,将其置于-80 °C过夜。在第二天显影。
- 可将另一张X光片放在印迹上,并放回-80 °C进行另一次曝光。
Northern印迹实验方案
Northern印迹实验方案类似于Southern印迹实验方案,只是RNA序列是在掺入甲醛的变性琼脂糖凝胶上分离。
RNA分离
- 哺乳动物细胞或组织(RTN70, RTN10 和 RTN350)可使用TRI Reagent® (T9424)或 GenElute™ 试剂盒从细胞或组织样品中分离 RNA
- 为了确定 RNA 的质量和浓度,分别在 260 nm 和 280 nm 处读取样品的吸光度。吸光度比值A260/A280为 1.8-2.1 表示 RNA的质量较好。
凝胶电泳
如果在电泳之前将溴化乙锭掺入琼脂糖中,则可以在运行后立即获得凝胶图像。
转膜
转膜设置、预杂交、杂交和检测的实验方案与Southern blotting相同。
材料
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?