评估Millex®针头过滤器在药品亚硝胺杂质检测中的应用
这些监管机构积极地监控并更新亚硝胺杂质相关指南以确保公众健康和安全。药厂在评估和控制药品中亚硝胺污染风险时,务必遵守这些指南和要求。
亚硝胺分析方法
全球监管机构(EMA、美国FDA等)都着重强调了稳健的分析方法对于药品中亚硝胺分析的重要性。LC-MS/MS。这种方法结合了高效液相色谱(HPLC)和串联质谱(MS/MS),具有高灵敏度、选择性和准确性等优势。LC-MS/MS能检测和定量复杂样品基质中微量级别的各种亚硝胺,适合日常分析,符合监管限度。美国药典通则USP <1469> Procedure 3使用LC-MS/MS方法定量亚硝胺。13美国FDA、欧洲药典、14新加坡卫生科学局(HSA)15和台湾食品药物管理署16也发布了测定雷尼替丁等药物中亚硝胺的LC-MS/MS方法。
HPLC联用高分辨率质谱(HPLC-HRMS或LC-HRMS)是亚硝胺分析的另一种重要方法。该方法可选择性区分类似亚硝胺的物质与真正的亚硝胺,保证检测结果的可靠性。美国FDA建立和验证了LC-HRMS方法,并还在17USP <1469> Procedure 1中总结了这种方法。7
HPLC-紫外/可见光检测方法也可用于亚硝胺分析。虽然其灵敏度低于LC-MS/MS法,但可以用作分析原材料、溶剂和辅料的快速方法。法国国家药品和保健品安全署(ANSM)提供两种基于HPLC-UV的分析方法。18,19
气相色谱-串联质谱(GC-MS/MS)是另一种常用的亚硝胺分析方法,检测灵敏度和特异性好,专用于挥发性亚硝胺。USP <1469>、10 台湾FDA13和瑞士药监局(Swissmedic)20使用GC-MS/MS法检测亚硝胺,新加坡卫生科学局(HSA)发布基于高分辨精确质量数气相色谱-质谱(HRAM-GCMS)的检测方法。21
亚硝胺分析的样品过滤要求
上述分析方法在进样前都需要先过滤样品。过滤是在进样前去除样品和流动相中颗粒的最简单方法,否则会对HPLC仪器性能造成严重影响。颗粒物在缬沙坦等药品中非常常见,主要由制剂溶解过程所引起。滤膜的孔径等级代表其截留样品颗粒的能力,HPLC法通常使用0.45 µm滤膜。使用小颗粒(例如,亚2 µm填料)装填柱子和UHPLC时,建议使用0.2 μm滤膜。值得注意的是,研究显示相同孔径滤膜的截留效率并不一定相同。22
表2是全球药监部门发布的各亚硝胺分析方法中的过滤步骤。建议过滤时使用针头过滤器。针头过滤器的两个重要属性是滤膜材质和孔径。PVDF和PTFE是发布方法中最常提到的两种滤膜材质,某些情况中也有提及尼龙和亲水聚丙烯(表2)。各方法中的孔径有0.2、0.22和0.45μm。
检测的针头过滤器。以下产品各取2批,每批取3个滤器:(1) Millex® PVDF 0.22 µm和(2) Millex® PTFE 0.2 µm。以下产品各取1批,每批取3个滤器:(3)供应商P PVDF 0.2 µm, (4)供应商C H-PTFE 0.2 µm, (5)供应商M PVDF 0.2 µm和(6)供应商M PTFE 0.2 µm。
第一部分:可提取物。为了测定针头过滤器中是否含有基线水平的亚硝胺类可提取物, 按照USP <1469>方法,对仅含有稀释剂(0.1% v/v甲酸水溶液)的样品加标4种同位素标记内标(IS)[10 µg/mL的NDMA-d6和NMBA-d3,1 µg/mL的NDEA-d10/NDBA-d18]。样品经涡旋、离心(10,000 rpm,10 min)、取上清液用13 mm针头滤器过滤。采用LC-MS/MS法分析滤液中的6种亚硝胺化合物。使用外标曲线法测定浓度,曲线浓度范围1.33 - 90 ng/mL(NDMA、NMBA、NEIPA、NDIP和NDBA)和0.66-69.4 ng/mL (NDEA)。
第二部分:回收率。按USP <1469>方法,对40 mg缬沙坦(valsartan dura,80 mg)进行粉碎、1%甲酸水溶液稀释、低浓度水平(L2)加标。样品经离心、过滤后,采用LC-MS/MS方法分析。
亚硝胺分析用过滤器评估
很多LC-MS和GC-MS检测亚硝胺杂质的方法中都涉及色谱分析进样前的样品过滤。这时,确保过滤器中不含有亚硝胺类可提取物对于保证检测数据的准确性和一致性非常重要。另外也需要进行回收率研究,因为某些分子会吸附过滤器组件,影响最终数据质量。
实验采用基于USP <1469> Procedure 3的验证方法评估针头过滤器。27该USP方法描述了通过LC-MS/MS定量分析部分沙坦类药物(缬沙坦、氯沙坦钾、奥美沙坦酯、坎地沙坦酯和替米沙坦)中的NDMA、NDEA、NDIPA、NEIPA、NMBA和NDBA。方法中的“样品溶解(Sample solution)”部分最后一句要求在离心后“使用0.45-μm孔径的亲水聚四氟乙烯(PTFE)滤膜”过滤。11
第一部分:可提取物
使用外标曲线法分析针头过滤器滤液中的亚硝胺可提取物,曲线浓度范围1.33-90 ng/mL(NDMA、NMBA、NEIPA、NDIP和NDBA)和0.66-69.4 ng/mL (NDEA)。图1为这些化合物的MRM谱图示例。
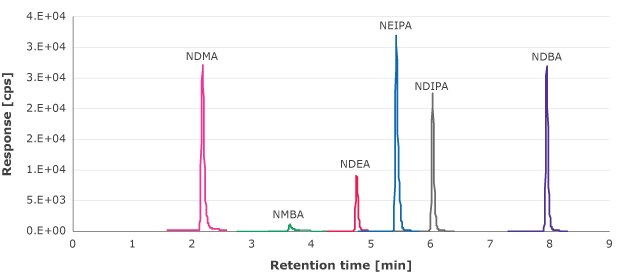
图 1.亚硝胺标准溶液的MRM谱图。(NDMA、NMBA、NEIPA、NDIP和NDBA为10 ng/mL,NDEA为6.6 ng/mL)
定量限(LOQ)定义为信噪比为10时候的浓度。每种亚硝胺杂质校准曲线的最低浓度的信噪比>10。所有受检的针头过滤器都没有检出等于或高于此浓度的亚硝胺(表5)。
缩写:S/N = 信噪比;PVDF = 亲水聚偏氟乙烯; PTFE = 亲水聚四氟乙烯;LOQ = 定量限;ND = 未检出
保证过滤组件不含有任何影响数据质量的化学可提取物十分重要,尤其是在用到高灵敏度仪器的时候。要避免可提取物是因为它们会与分析峰共洗脱,或者在下游分析时显示为超出意料的峰,增加数据解读的难度。可提取物的来源包括过滤器脱落、生产工艺残留化学品或过滤器洗脱时的次生化学试剂。对于特定分析物比如亚硝胺化合物来说,制膜工艺中可能意外引入了这类可提取物。
第二部分:缬沙坦回收率
该回收率实验采用低浓度水平(L2)的标准品制备缬沙坦加标样品。通过LC-MS/MS分析制备好的样品溶液,采用外标曲线法计算各分析物浓度。测定样品溶液和外标溶液中内标信号与分析物信号的比值,例如NDMA-D6信号/NDMA信号。
表6显示受检PVDF和PTFE针头过滤器的平均回收率。对于所有受检器材,全部化合物的回收率都落在70-130%31的可接受范围内。不同化合物和滤器材质的回收率明显有些差别。例如,NDBA的回收率相对较低(仍在可接受范围内),可能是它会与滤器介质或药品成分发生疏水作用。Millex®的两种亲水性针头过滤器(PVDF和PTFE)均具有批次间一致的回收率。
选择针头过滤器材质时,还需要考虑分析物分子会否吸附过滤器,因为这种结合会降低回收率。受检分子的化学性质和过滤器(滤膜和外壳)的理化性质决定了结合程度。各种次级相互作用,例如静电作用、氢键作用和疏水作用,都会导致分析物吸附滤膜和外壳。32本研究中,无论使用PVDF还是PTFE滤膜,NDMA的回收率都相对较低(仍在可接受范围内),可能就是因为NDMA与膜发生了疏水作用。PVDF膜的NDIPA回收率偏低,说明该分子对PTFE和PVDF聚合物的作用力有差别。其他带有极性官能团且非特异性结合趋势更高的聚合物,比如尼龙,很有可能结合力更高,分析物损失会更多。因此,为了获得最准确的回收率,建议在样品制备时弃去第1 mL的滤液,比如美国FDA的亚硝胺检测方法所述。23,24 这样可以保证膜的结合位点已经被分析物饱和,不再造成额外的分析物损失。我们已经发现,就算高结合力的膜材质(如尼龙)也适用这种操作。
相关产品
相关应用
- 小分子分析与质控(QC)
符合国际药典标准的小分子分析和质控(QC)对于药物研发至关重要。分析化学和微生物检测确保小分子的开发和生产符合药品生产质量管理规范(GMP)。
- 药典检验与监管指南
药典检验对于辅料和药品放行至关重要。USP和EP等国际药典都为此制定了相应的质量标准。进行检验并符合药典方法所述标准,是对药物成分和药品的基本要求。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?