过滤在(U)HPLC和LC-MS性能优化中的重要性
HPLC样品过滤的Millex®针头过滤器
Millipore®滤膜和过滤器,用于流动相/溶剂过滤
众所周知,适当的样品制备技术对于高品质数据的获取至关重要。(U)HPLC和LC-MS分析前的样品制备有时会省略过滤步骤,但这会造成不利后果,因为样品和流动相中的颗粒物会破坏色谱柱和仪器的性能。我们研究了Millex®针头过滤器的颗粒截留能力,并与其他同类产品进行比较,然后将颗粒截留效率(或截留率)与柱寿命相关联,其中在UHPLC系统中进样过滤和未过滤样品,同时监测反压多达500次进样或直至超过设定截止压力。此外,还评估了流动相过滤对柱反压的影响。这些数据证实了过滤在HPLC色谱柱寿命优化中的重要性。
UHPLC、HPLC和LC-MS中的过滤
高效、超高效液相色谱(HPLC, UHPLC)和液相色谱-质谱(LC-MS)技术是药物开发和制药QC、学术和政府研究、食品饮料分析及临床和环境检测的常用分析方法。这些方法涉及最简单、最经济的样品制备技术之一—过滤,即滤除样品中的颗粒物。1样品中的不溶颗粒物,即使浓度再低,也有可能堵塞HPLC柱子,引起仪器反压升高和柱寿命缩短,并影响数据质量。2,3因此,过滤去除样品颗粒可以规避这些问题,同时有可能提供更清晰的色谱数据。4
过滤对于(U)HPLC和LC-MS的流动相制备来说也同样重要。5,6,7 市面上的HPLC、UHPLC、LC-MS和MS级别溶剂经过预滤处理,无需额外过滤即可从瓶中直接用作流动相。但是不少分析方法会用到流动相缓冲液或混合溶液,需要加入磷酸盐和乙酸盐等盐类。8在这些情况下,建议使用前先过滤缓冲液,9并即取即用。8
我们研究了各种针头过滤器的截留效率, 并比较了经过和未经样品过滤时的柱寿命。
不同针头过滤器的截留效率
截留率指过滤时成功除去的样品颗粒物比率,同时也说明了可以穿过滤器进入仪器的颗粒物比率。我们使用4个厂家的针头过滤器评估颗粒截留率。针头过滤器的材质为亲水聚四氟乙烯(PTFE)或再生纤维素(RC)。0.45 μm针头滤器对0.5 μm直径微球、0.2 μm针头滤器对0.24 μm直径微球,用0.05% (v/v)的微球水溶液进行过滤检测。受检针头过滤器每批取n=4,大多数情况下会取多个批次。过滤3 mL微球水溶液后收集滤液,用荧光法或分光光度法(比对6点标准曲线)测定。
表1显示受检4种0.45 μm针头过滤器的截留率。不同膜材质的截留效率不同,再生纤维素最低(48.2+/-4.3%),PTFE可截留98-100%的聚苯乙烯微球。
对于HPLC来说,0.45 µm滤膜过滤已经足够。但当色谱柱装填细小颗粒时(例如,亚2µm颗粒,或UHPLC),就需要0.2 μm滤膜。5,10UHPLC色谱柱由于进样口筛板孔隙率、间隙和管径都变小,更容易发生堵塞。因此,我们也评估了0.2 μm针头过滤器对0.24 μm微球的截留率(表2)。再生纤维素滤器的截留率低于20%,说明80%以上需要滤除的颗粒物都穿过了滤膜。3种亲水PTEF滤器的截留率各不相同,2号生产商(MFR #2)最低,并且批次间一致性也比较差。
每个0.45 μm针头过滤器每次试验都使用一个新柱子。每次试验时都对管线、进样器、密封件和HPLC系统进行彻底清洗(包括装柱和不装柱),确保完全清除上一次试验后残留系统的颗粒物。每次安装新柱后,先用70:30 乙腈:水(1 mL/min)冲洗系统10分钟,接着用流动相(表3)平衡至系统形成稳定的反压基线,一般约需10-15分钟。
用0.45 μm针头过滤器将0.05% (v/v)的0.5 μm聚苯乙烯微球滤入HPLC认证样品瓶。将滤液进样到UHPLC色谱仪中。每次10 μL,反复进样至到达或超过截止反压(8000 psi)。未过滤样品也直接进样。结果如图1。
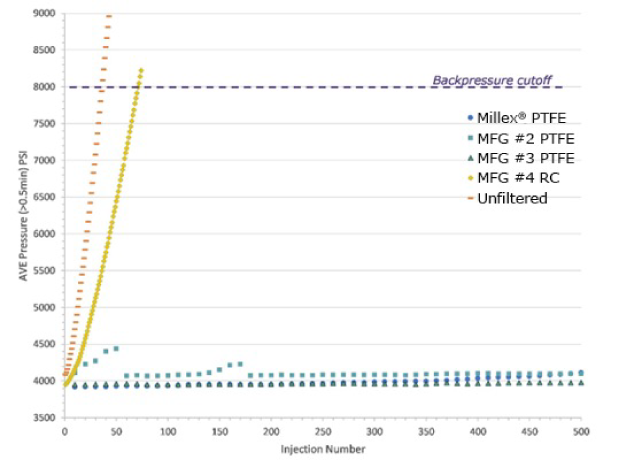
图1 .样品过滤对UHPLC系统反压的影响。以过滤和未过滤的0.5 μm微球0.05% (v/v)溶液的进样次数为横坐标,平均反压(psi)为纵坐标绘图。过滤样品来自3种0.45 μm亲水PTFE针头滤器和1种再生纤维素针头滤器,生产商均不同。也进样未过滤样品。
在超过截止压力(8000 psi)之前,未过滤样品仅能进样36次。再生纤维素滤液进样71次后超过截止值。说明颗粒会快速堵塞色谱柱,即使仅进样10 μL也会严重损害柱子寿命。联系上述截留率数据,再生纤维素针头过滤器仅能截留溶液中48%的颗粒,意味着约50%需被滤掉的颗粒物进入了UHPLC系统。PTFE过滤样品全部可进样超过500次,并且柱反压无明显变化。因为如前所述,这种针头滤器可截留近100%的颗粒物。
流动相过滤用滤膜评估
过滤对于(U)HPLC和LC-MS应用的重要性并不仅限于样品过滤。流动相中存在的颗粒物同样也会使(U)HPLC发生严重问题。Joshi等人研究发现,流动相中颗粒清除不彻底同样会增加UHPLC色谱柱的反压(图2)。7,11该研究中,流动相(50:50 乙腈:水)经聚丙烯(PP)和亲水PTFE滤膜过滤(孔径0.2 μm和0.45 μm),再以0.25 mL/min流速连续流过UHPLC色谱柱,监测反压超600分钟。
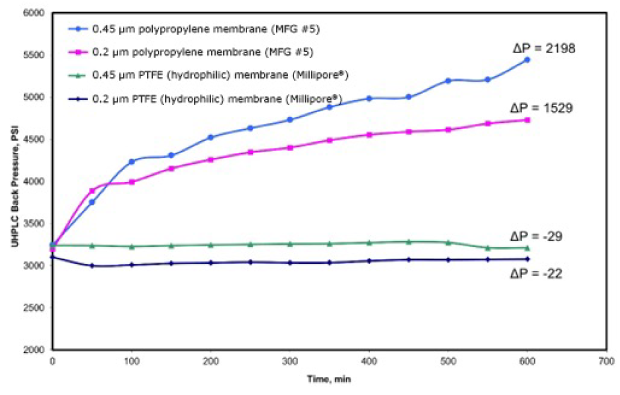
图2.UHPLC系统反压(psi)与时间(min)关系图,流动相以0.25 mL/min速度流动600分钟。流动相经0.2 μm和0.45 μm聚丙烯(PP)和PTFE滤膜过滤。(参考文献11 ,经允许复制)
受检的4种滤膜中,0.45 μm和0.2 μm聚丙烯膜过滤的流动相反压升高最多。除了之前讨论过的柱问题,流动相中的颗粒物还会造成仪器组分提前损坏,包括泵止回阀、活塞和密封件。12需要特别注意的是,比起进样,在实验中用量高很多的流动相如果存在颗粒物,接触柱子后会加速加剧柱堵塞效应。
滤膜截留影响因素
样品和流动相的过滤是通过滤膜进行的,它作为微孔屏障,通过膜孔按照物理大小排阻基质中的颗粒物。其中的问题是,有时候大于膜标称孔径的颗粒物也能穿过,或者小于孔径的却不能穿过,导致不同的截留结果。
微滤膜不同的膜孔性质,例如形状、大小、频率、分布和对称性,决定了滤膜如何截留特定大小的颗粒。本滤膜截留研究中,孔径相同的来自不同生产商的PTFE滤膜,尤其是0.2 µm孔,对相同的颗粒表现不同的截留效果。可能是因为不同生产商的实际孔径分布和孔隙率更宽或更窄。换句话来说就是,从最小到最大的各孔径可能相差非常大。还有不同供应商的制膜工艺也不同(即使使用相同材料)。因此不同材质,有时候甚至是不同批次的孔形状都不相同,尤其是工艺没有严格控制时。另外,各生产商检测孔隙率和孔径的方法也不相同,检测方法选择很多,包括透气性、起泡点、纯水透过性、BET分析、孔径分析或截留法。
使用针头过滤器进行(U)HPLC和LC-MS样品制备时,需要考虑的不止于颗粒截留率。其他膜特性,包括化学性质和化学相容性、滤膜直径、厚度、外壳以及待过滤溶液和分析物的化学性质,对滤膜的总体性能同样有较大影响。13
过滤,柱堵塞和HPLC分析
在(U)HPLC分析之前过滤样品是不错的做法。5可以防止色谱柱过早堵塞和仪器反压升高,避免不必要的关机和实验室生产效率损失,同时维护数据质量。截留率的研究结果说明,使用针头过滤器过滤含颗粒样品用于(U)HPLC进样时,不同滤器产品对色谱柱的保护作用不同。
孔径等级相同的针头过滤器可能具有不同的颗粒截留效率。只有选择能高效截留颗粒物的过滤器,才能保护(U)HPLC柱子不会过早堵塞。流动相也需要过滤,因为颗粒物不但能堵塞柱子,随时间累积下来也会导致仪器组件损坏。因此,为了保护HPLC色谱柱寿命并获得一致的高质量数据,一直都要把样品和流动相过滤纳入考虑。
推荐产品
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?