I期-II期

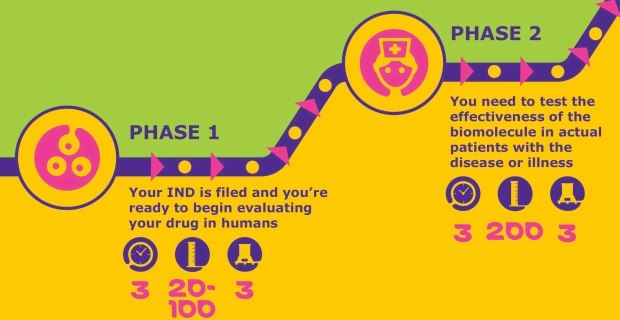
一旦新药临床试验(IND)申请获批,就可以开始I期临床试验。在此开发阶段,候选药物将被用于健康人群进行安全性测试。
此时可以对生产能力进行开发、标准化和扩展,并确保适当的分析和质量控制工艺和标准化产能准备到位。
候选药物的安全性获得确认后,II期试验将评估药效。这个阶段的成功会引起合作伙伴和投资者的兴趣。这一阶段侧重于工艺的规模放大和进一步优化,并确保内毒素水平和无菌性符合监管要求。
推荐类别
生物技术资源
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
- A Molecule’s Journey: Breaking Down Roadblocks to Clinical Success
A guidebook for biopharma executives navigating the complexities of clinical development. Learn how to successfully bring a molecule from the lab to the clinic.
- Quality and Regulatory Trends
Explore how we ensure high-quality products and services with a focus on compliance, risk management, and a strong code of conduct.
- Using a 3L Disposable Bioreactor to Increase Your Throughput Development Capacity
This webinar showcases the efficiency and economy of single-use bioreactors. Discover how using a 3L single-use bioreactor can enhance your throughput development capacity in therapeutic protein process development.
- Biosimilar Upstream Process Development – The Challenges and Promises
Explore the challenges and promises of biosimilar upstream process development. Learn how process changes impact product quality and achieve consistency in manufacturing.
- Mobius Single-Use Bioreactors Scalability: Bench to Clinical Scale
Discover how Mobius® Single-use Bioreactors enhance throughput development capacity, offering scalable solutions from bench to clinical scale.
我们可以提供哪些帮助
如有任何疑问,请提交客户支持请求
或联系我们的客户服务团队:
发送电子邮件至 custserv@sial.com
或致电 +1 (800) 244-1173
更多支持
- 计算器与应用_缓冲液计算器_HPLC方法转换计算器-默克生命科学
默克该工具箱包括用于化学、生命科学、材料科学等方面的科学研究工具和资源。
- Customer Support Request
Customer support including help with orders, products, accounts, and website technical issues.
- FAQ
Explore our Frequently Asked Questions for answers to commonly asked questions about our products and services.
如要继续阅读,请登录或创建帐户。
暂无帐户?






