临床前

临床前测试是为了确立目标化合物进行下一阶段人体测试所必需的安全性和药效。在这个阶段, 体外 和 体内 测试可能长达数年之久。如果试验成功,就可以准备提交新药临床试验(IND) 申请。
生物技术资源
- FDA Investigational New Drug (IND) Application
Explore FDA’s guidance on IND applications, a crucial step in drug development for biotech startups. Navigate regulatory intricacies efficiently.
- Emerging BioTalk Blog
Your gateway to the latest news in biotech. Dive into discussions on market trends, bioprocessing, and technologies for novel modalities. Join the discussion today.
- Brochure: Integrated Bioprocess Solutions
Navigate the path to commercialization with our comprehensive guide for Biopharmaceutical Startups. Accelerate your journey with our range of tools and services.
- Biopharmaceutical Application Guide
Navigate the biopharmaceutical landscape with our application guide, providing resources and solutions for mAb, ADC, and mRNA processes.
毒理学试验服务 至关重要。为此需要进行多项 体外 和 体内 毒理学试验,且此类试验必须按国际指南设计,操作过程完全符合实验室良好操作规范(GLP)。
工艺开发考虑因素
- 细胞系开发
- 克隆筛选
- 培养基及补料筛选
- 上游工艺开发
- 主细胞库建库
- 下游工艺开发
- 制剂开发
- 分析方法开发和优化
- 分析工艺开发支持
- 生物仿制药兼容性分析计划
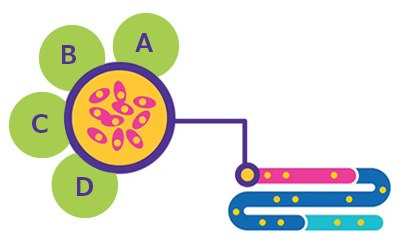
图 1.细胞系基开发。A. BioReliance® 产品特征鉴定。B. BioReliance® 细胞建库和储存。C. BioReliance® 细胞系开发。D. BioReliance® 细胞系特征鉴定。
细胞系开发考虑因素
- 克隆筛选 — 生产生物制剂的细胞系必须具有足够高的滴度和质量
- 稳健性研究 — 研究复制放大条件
- 遗传稳定性 — 细胞传代60次以上后,蛋白表达和质量仍应保持稳定
工艺开发考虑因素
- 工艺效率 — 取消冗余步骤,优化产能利用率
- 工艺可行性 — 通过规模放大和技术转移实现可再现性
- 财务可行性 — 平衡生产力和成本

技术考虑因素
- 灵活性— 一次性设备可增强灵活性、模板定制能力、可快速装载组件,并降低清洁成本
- 可扩展性— 于早期阶段技术选择时,如将哺乳动物细胞培养的生物反应器从3 L放大到200 L再到2000 L
- 易用性 — 解决方案包括预先组装的无菌工艺物料流道;可用于无菌连接、断开连接和重新连接的接头
监管考虑因素
- 患者安全 — 临床开发的各个里程碑必须评估安全性和产品有效性
- 产品质量和工艺稳健性 — 数据收集和分析需要进行确认
- 申报策略 — 了解申报所在国家指导检查生产设施的责任机构
商业考虑因素
- 加快进入临床试验 — 大量无回报的资金正投入研发
- 工艺效率 —积极考虑放大生产的速度,不仅仅是初期速度
- 申报策略 — 选择要首先申报的国家,尽快获得上市许可
适当的资源支持可让您心无旁骛,集中精力发现最具潜力的新药以满足患者所需。选择开发过程的任一阶段开始探索,或点击产品和服务链接获得支持资源。
如要继续阅读,请登录或创建帐户。
暂无帐户?









