聚糖标记
用于代谢聚糖标记的 GlycoProfile™ 产品
蛋白质的结构修饰对于活细胞是必不可少的。发生调节异常时,它们往往是会引发疾病。聚糖是生物系统中许多结构变异的原因,它们在细胞表面的表现通常被称为“糖”。研究人员开始看到通过糖组学研究碳水化合物、蛋白质、糖蛋白及其相互作用在医疗保健方面取得突破的潜力。
- 聚糖生物合成的生物正交标记反应
- 使用 FLAG®的功能进行检测和富集
我们通过代谢标记 N-叠氮基乙酰半乳糖胺、乙酰化 (Gal-NAz)、N-叠氮基乙酰葡糖胺、乙酰化 (GlcNAz) 和/或 N-叠氮基乙酰甘露糖胺、乙酰化 (ManNAz),修饰的Staudinger与FLAG-膦探针的连接,来快速分析 N 和 O-连接糖蛋白的工具。用 ANTI-FLAG®结合物稳固标记或富集糖蛋白,可实现糖基化机制或代谢的分析。代谢标记,然后修饰的Staudinger连接,为这种翻译后修饰的蛋白质组学分析和鉴定与疾病相关的糖蛋白指纹提供了一种手段。
细胞利用糖基转移酶代谢叠氮糖,并在细胞内和细胞表面表达聚糖链上的糖,叠氮基未反应。叠氮糖也可以通过唾液酸代谢途径结合到聚糖中。将含有检测 FLAG 表位的选择性膦探针应用于含有叠氮聚糖的细胞或提取物。膦基团通过Staudinger连接与展示的叠氮基选择性反应,产生与聚糖共价连接的表位标签。
虽然是非天然分子,叠氮基和膦部分在细胞增殖过程中都是可耐受的。然后使用 FLAG 特异性抗体检测结合的表位肽。通过该方法可以分析受特定聚糖翻译后修饰调节的途径以及监测细胞内糖基化过程本身。用生物正交化学报告基因如叠氮糖进行代谢标记,然后进行Staudinger连接,为这种翻译后修饰的蛋白质组学分析和鉴定与疾病相关的糖蛋白指纹提供了独特的方法。
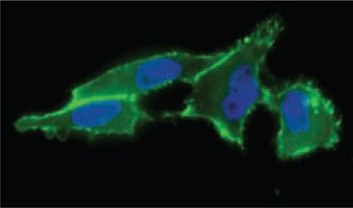
图 1.使用 ANTI-FLAG®-FITC(货号 F4049)(绿色)检测细胞表面唾液酸表达,发现FLAG-膦与乙酰化的N-叠氮基乙酰基甘露糖胺反应。

图 2.通过用叠氮基 GalNAc 类似物 (GalNAz) 进行代谢标记,然后用磷化氢探针 (FLAGphosphine) 进行 Staudinger 连接来分析 O 型糖蛋白。
参考文献
GlycoProfile™ 标记试剂盒
用于增强聚糖分析的有用荧光染料
2-AA和2-AB还原胺化标记聚糖
GlycoProfile 2-AA和GlycoProfile 2-AB标记试剂盒包含通过还原胺化在其还原端标记聚糖的试剂。荧光团2-AA(邻氨基苯甲酸)和2-AB(2-氨基苯甲酰胺)为聚糖分析提供了有价值的工具,因为它们在与聚糖偶联时具有灵敏度和稳定性。其他常用的方法,如放射性同位素标记、抗体标记和各种探针无法达到使用2-AA 和2-AB时观察到的稳定性、灵活性和易用性。
在两步还原胺化过程中标记聚糖。具有游离还原糖的聚糖在环状或闭合环与非环状或开环结构之间处于平衡状态。在第一步中,当无环还原糖的羰基碳以亲核方式被染料攻击时,会形成稳定的席夫碱。席夫碱形成后,用氰基硼氢化钠还原得到的亚胺基团,得到稳定的标记聚糖。
使用2-AA/2-AB的标记可以在纯化或混合的样品上进行,包括多种来源,如N-连接的、O-连接的和GPI锚定的聚糖。对于含有唾液酸化寡糖的样品,唾液酸损失可以忽略不计。含有混合聚糖池的样品通常可以在飞摩尔级浓度下检测到。聚糖与两种染料的结合非常牢固,在净化后分析过程中不会发生降解。
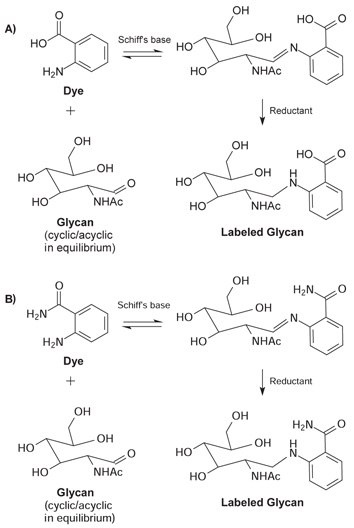
图 3.无环聚糖和染料形成席夫碱。随后用氰基硼氢化钠还原亚胺得到稳定的标记聚糖。(A) 2-AA 荧光团 (B) 2-AB荧光团。
2-AA和2-AB标记的聚糖的分析
聚糖被标记后,就可以用多种方法来分析它们。最常用的方法是用 HPLC 或 CE 分离后进行荧光检测。包括离子交换分离,正相/反相高效液相色谱或尺寸排阻色谱。
紫外检测未检测到标记的聚糖,但通过荧光可见明显的峰。色谱图的差异来源于标记效率、灵敏度和其他染料性质。UV 和荧光检测都不能检测到未标记的胎球蛋白聚糖(数据未显示)。标记的聚糖也可以用质谱法检测。可以使用电喷雾电离 (ESI) 或基质辅助激光解吸电离 (MALDI) 离子源进行质谱分析。含有混合聚糖池的样品通常可以在皮摩尔浓度下检测到。
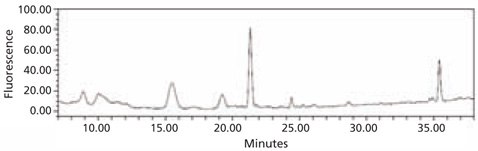
图 4.从牛胎球蛋白获得的2-AA标记的N-连接聚糖文库的HPLC图谱。使用酶蛋白去糖基化试剂盒(货号 EDEGLY)从糖蛋白中切割聚糖。
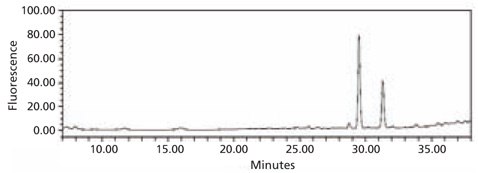
图 5.从牛胎球蛋白获得的2-AB标记的N-连接聚糖文库的HPLC图谱。使用酶蛋白去糖基化试剂盒(货号EDEGLY)从糖蛋白中切割聚糖。
GlycoProfile™ 2-AA和2-AB标记试剂盒
每个GlycoProfile™标记试剂盒包含足够的试剂,可标记多达36份样品。我们提供了两套组分;根据5 μl的反应体积,每一组都足以标记多达18份样品。混合聚糖样品应含有 100 皮摩尔至 50 纳摩尔的纯化聚糖。使用单一的纯聚糖时,仅需 5 皮摩尔就可以在随后的 HPLC 分析中进行标记和检测。
附加标记试剂
化学衍生化是还原胺化在聚糖还原端标记聚糖的最常用方法。每个单糖或寡糖都可以掺入一个荧光标记分子。该技术的检测灵敏度在低飞摩尔范围内,依据分析技术,可以使用适当的荧光标记。表 1列出了在聚糖分析中广泛使用的除2-AA和2-AB之外的一些荧光基团。
注意:美国专利号5,747,347及其国外等效物涵盖了用2-AB标记聚糖的技术。
材料
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?