N-连接聚糖概述
N-连接聚糖简介
N-连接糖基化、修饰和降解涉及从古细菌到真核生物的所有生物中的多种过程。它是真核细胞中最常见的共价蛋白修饰。其具有化学复杂性和多样化的功能,是其它翻译后蛋白修饰无法比拟的
结构
所有N-连接聚糖都基于共同的核心 — 五糖Man3GlcNAc2(参见图1)。高尔基体进一步加工导致形成三大类N-连接聚糖:
- 高甘露糖
- 杂合类
- 复合类

图 1.所有N-连接聚糖的核心结构。
高甘露糖聚糖含有未取代的末端甘露糖(参见图2)。这些聚糖通常含有5至9个与壳二糖(GlcNAc2)核心相连的甘露糖残基。名称缩写代表了结构中甘露糖残基的总数。
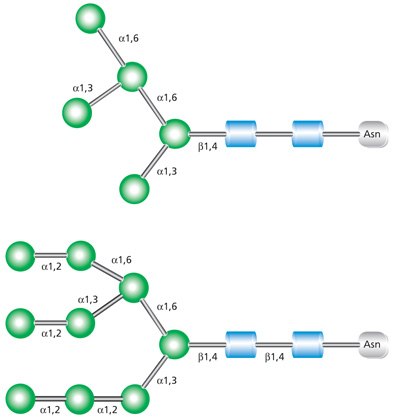
图 2.高甘露糖聚糖Man-5(上图)和Man-9(下图)的示例。
杂合聚糖的特征在于含有未取代的末端甘露糖残基(如存在于高甘露糖聚糖中)以及取代了甘露糖残基的N-乙酰葡糖胺键(如存在于复合聚糖中)(参见图3)。在杂合和复合N-聚糖中,添加到N-连接聚糖核心的这些GlcNAc序列称为“触角”。图3中上图所示的结构是双触角聚糖,其具有与核心连接的两个GlcNAc分支。下图所示的结构是具有三个GlcNAc分支的三触角聚糖。
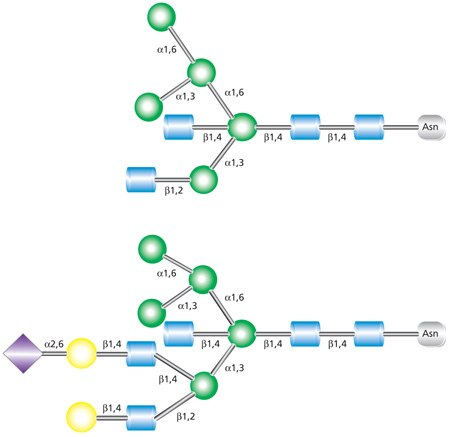
图 3.双触角(上图)和三触角(下图)杂合聚糖的示例
复合类N-连接聚糖与高甘露糖聚糖或杂合聚糖不同,它在α-3和α-6甘露糖位点添加GlcNAc残基(参见图4)。与高甘露糖聚糖不同,复合聚糖除核心结构外不含甘露糖残基。另外的单糖可以在重复的乳糖胺(GlcNAc-β(1→4)Gal)单元中出现。复合聚糖以双、三和四触角形式存在,并构成细胞表面和分泌的N-聚糖的大部分。复合聚糖通常以唾液酸残基为末端。也可能存在其他修饰,例如在甘露糖核心上添加二等分GlcNAc(如图4所示)和/或在最内部的GlcNAc上添加岩藻糖基残基。
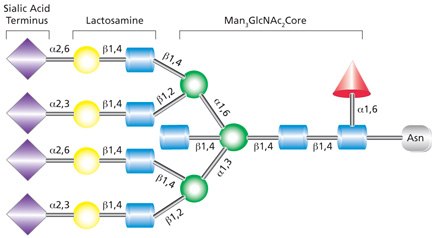
图 4.四触角复合聚糖的示例,含有末端唾液酸残基,在五糖核心上有二等分的GlcNAc,并且在核心GlcNAc上岩藻糖基化。
生物合成和降解
N-连接聚糖的蛋白质糖基化实际上是在蛋白质合成期间发生的共翻译事件。N-连接糖基化发生在共有序列Asn-X-Ser / Thr,在这里聚糖连接到天冬酰胺的胺基,X代表除脯氨酸外的任何其他氨基酸。当该共有序列出现在肽内的环中时,最常发生糖基化。
最终用于蛋白质掺入的寡糖中间体通过内质网(ER)细胞质侧上的一系列转移酶而合成,与此同时被连接到多萜醇磷酸盐(P-Dol)碱基。在添加甘露糖和N-乙酰基-D-葡糖胺分子之后(该过程通常使用GDP-Man和UDP-GlcNAc作为聚糖供体),从ER细胞质侧移动之前的最后构建体是Man5GlcNAc2-P-Dol(参见图5)。
该多萜醇前体及其附着的聚糖被转移至ER的内腔(“翻转”)以进一步酶促修饰。处理过程包括用糖苷酶修剪葡萄糖和甘露糖残基,以及通过ER中(而且很大程度上是高尔基体中)的糖基转移酶添加新的残基。在高尔基体中,高甘露糖N-聚糖可以转化为脊椎动物特有的各种复合和杂合形式。然后通过寡糖基转移酶(OST)将完成的寡糖从多萜醇前体转移至靶蛋白的Asn。

图 5.ER中N-连接聚糖构建的一般过程。聚糖前体在ER的细胞质中组装在多萜醇磷酸盐碱基上(A)。一旦聚糖切换到腔侧(B),聚糖在附着于蛋白质之前添加和去除(修剪)了额外的糖(C),在这个阶段发生了一些额外的加工处理(D)。
切割后的高甘露糖聚糖在高尔基体中充当底物,在这里发生额外的修饰和多样化。高甘露糖结构通过甘露糖苷酶的作用被修剪,去除了甘露糖延伸,然后通过N-乙酰葡糖基转移酶的作用添加GlcNAc糖(“触角”),从而使聚糖转化为杂合和复合聚糖。哺乳动物基因Mgat1编码N-乙酰葡糖基转移酶-I(GlcNAcT-I),负责在β(1→2)键中添加一个GlcNAc。随后修饰的聚糖成为α-甘露糖苷酶 II 的底物,该酶除去α(1→3)和α(1→6)甘露糖残基,并产生通过Mgat2 基因编码的GlcNAcT-II(N-乙酰葡糖基转移酶-II)贡献葡萄糖基团的分子结构。GlcNAcT-II 的催化作用将另外的GlcNAc基团连接到杂合结构上,从而将杂合聚糖转化为复合聚糖。
在杂合和复合N-连接合成中,在GlcNAcT-I 修饰之后,核心GlcNAc残基的岩藻糖基化也是常见的。在脊椎动物中,岩藻糖在α(1→6)键上加入,而在植物和无脊椎动物中,岩藻糖在α(1→3)键上加入。
在N-连接聚糖的研究中,抑制或消除糖基化可以由许多化合物引起。密实菌素(康帕丁)、辅酶Q或外源性胆固醇可强烈抑制N-糖基化。用衣霉素处理可完全阻断糖基化,因为衣霉素抑制GlcNAc C-1磷酸转移酶,这种酶在多萜醇前体的形成中起关键作用。
α-甘露糖苷酶、β-甘露糖苷酶、唾液酸酶和α-岩藻糖苷酶是参与N-连接聚糖修剪和降解的主要外切糖苷酶。昆虫细胞表达N-乙酰葡糖胺酶,其切割N-连接聚糖的末端GlcNAc残基。
功能
在发育过程中,糖蛋白的中间结构发挥特定作用。在糖蛋白进化的早期阶段,不同的核心寡糖结构对于适当的蛋白质折叠和官能团取向是必需的。不正确折叠的蛋白质被重新糖基化并重新折叠,或者被去糖基化和降解。在后期阶段,寡糖基团是细胞内转运以及靶向内质网、高尔基复合体、和反式高尔基体网络中的糖蛋白所必需的。在最后阶段,N-连接的聚糖在高尔基复合体中经历广泛的修饰,产生成熟的糖蛋白。
尽管是共价连接的,但蛋白质基团和所连接的亲水性N-连接聚糖是相对独立的,即可以修饰聚糖而不显著影响蛋白质结构和功能。蛋白质可含有多个糖基化位点,这些位点用三类N-连接聚糖中的任何一种修饰。已发现脊椎动物由于在基因组内编码的多种糖苷酶和糖基转移酶而具有复合和杂合糖蛋白的多种补体。虽然这三类N连接糖蛋白也存在于低等生物体中,但结构的多样性少于脊椎动物糖蛋白。
除了能够含有多个聚糖结构的特定糖蛋白外,相同糖蛋白的不同分子,可以具有不同的聚糖结构连接到相同的取代位点。聚糖结构中的修饰在发育、分化、转化、维持和衰老阶段为不同细胞类型和相同细胞类型提供鉴别特征。蛋白质糖基化的这种变化被称为微观异质性,造成鉴别和分离特定糖蛋白的困难。
先天性糖基化障碍(CDG)是因酶缺乏而造成的与代谢错误相关的一系列疾病。大多数确诊CDG是由于N-聚糖的生物合成或降解失败造成的,这是因为缺少一种参与N-糖基化的酶,主要是外切糖苷酶α-甘露糖苷酶、β-甘露糖苷酶、唾液酸酶或α-岩藻糖苷酶。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?