用于细胞递送和组织再生的可注射水凝胶
简介
将基于水凝胶的生物材料用于递送和募集细胞以促进体内组织再生是新生的研究热题。1水凝胶是由多种天然和合成聚合物合成砌块形成的亲水性水溶胀聚合物网络(图1)。这些合成砌块经过工程学设计可通过化学反应或细胞及蛋白质的物理相互作用实现交联,在此过程迅速进行注射或形成原位水凝胶。本文回顾了这些可注射水凝胶的设计原理,聚合物和化学成分的形成进展以及它们在组织再生中应用的最新实例。
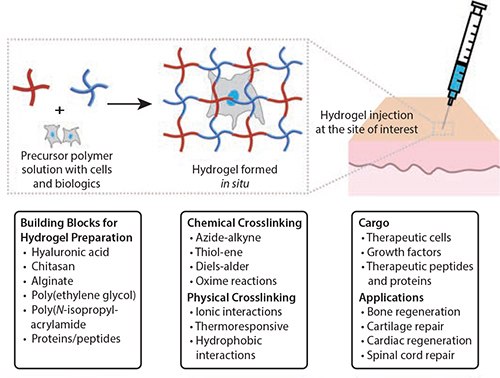
图 1.用于细胞递送和组织工程应用的可注射水凝胶。可注射水凝胶可通过多种天然和合成聚合物、重组蛋白质和肽来制备。使用化学反应或物理相互作用,这些基质材料在细胞、生物制剂和组织中通过化学反应或物理相互作用交联。这种原位形成的可注射水凝胶已用于递送多种治疗性细胞或生物制剂(如生长因子,具有调节功能的内源性细胞的趋化因子)以促进组织(包括骨骼,软骨和皮肤(文中))的再生。
用于设计可注射水凝胶的聚合物合成砌块
可注射水凝胶的制备使用多种材料。选择细胞和生物相容性及化学反应性的基础材料是制备可用于细胞递送或体内募集的水凝胶的关键因素。材料交联(物理或共价键的形成和密集度),生物可降解性和生物化学性质也是重要的设计标准,在初始和随后过程中影响水凝胶的结构,力学和生物学性质。并且基础聚合物材料在用于转化医学或临床研究之前必须以固体或溶液形式稳定存储。
制备水凝胶的亲水聚合物通常可以分为两类:由组织或其他天然来源衍生的天然聚合物及使用有机化学和分子工程学原理制造的合成聚合物。生物相容性天然聚合物,如透明质酸、壳聚糖(货号448869、448877和419419)、肝素、藻酸盐、纤维蛋白(货号F5386)、胶原蛋白(货号804592、804622和804614)、硫酸软骨素和蚕丝,可模拟天然微环境的各个方面,包括其调节细胞粘附、迁移和组织再生及其他关键功能的力学和生物化学特性。2这些天然聚合物已被用于通过物理(如离子,氢键)或共价交联(如修饰聚合物官能团的反应)形成可注射水凝胶的合成砌块。3合成聚合物,如聚乙二醇[PEG]、聚乙烯醇[PVA]、聚(N-异丙基丙烯酰胺)[PNIPAAm]和聚己酸内酯[PCL],由于其价廉易得、批次间差异小、化学修饰多样化并易于调节所得水凝胶的力学性能,经常用于设计可注射的细胞相容性水凝胶。由于合成聚合物缺乏与细胞相互作用的内在生化因子,因此与天然聚合物或仿生肽结合使用可促进细胞粘附、迁移和蛋白质分泌。
为了利用传统天然和合成聚合物的有利属性,合成肽和重组蛋白被设计用于细胞递送的注射和随后的原位组装。这种组合的实例包括混合诱导的双组分水凝胶(MITCH)中含有节肢弹性蛋白质,富含色氨酸和脯氨酸的序列以及与疏水性脂肪酸缀合的具有亲水肽段(赖氨酸或谷氨酸重复序列)的肽两亲物。4这些设计合成砌块被整合素结合肽序列工程化以促进细胞粘附和形成细胞驱动重构的可降解序列。本文将重点介绍几种经常设计可用于细胞递送和组织再生的可注射水凝胶的聚合物。
透明质酸(HA)(货号 H5542)是在结缔组织,上皮组织和神经组织的细胞外基质中发现的非免疫原性,生物相容性糖胺聚糖。基于透明质酸的生物材料在体内可被透明质酸酶降解并已用于多种生物医学应用。5Young等报道了使用可注射的透明质酸水凝胶递送用于视网膜修复的视网膜祖细胞(RPC)。6市售的硫醇官能化的透明质酸与丙烯酸酯官能化的聚乙二醇反应并在小鼠视网膜祖细胞中形成化学交联的水凝胶。注射水凝胶使视网膜祖细胞在视网膜空间内的均匀分布,并向预期的光感受器分化。透明质酸已被许多与注射后原位形成相关的反应性官能团修饰。7在最新的实例中,Burdick等用醛和肼官能团修饰透明质酸产生可注射的水凝胶,其释放重组组织抑制剂基质金属蛋白酶(TIMP3)并调节肌成纤维细胞的活性,改善心肌梗塞后组织的再生。8
藻酸盐(货号180947)是一种从褐藻提取的阳离子生物聚合物,已用于伤口敷料等多种临床应用。二价阳离子存在时,藻酸盐形成物理交联的水凝胶,并可通过改变聚合物量、分子量和可交联阳离子的浓度,调节其力学性能。基于藻酸盐的可注射水凝胶已被用于多种组织的再生,包括骨骼、软骨、脂肪和心脏组织。9Kim等通过对小鼠活体注射载有冻存预处理过的人脂肪干细胞(hADSC)的藻酸盐水凝胶来显示脂肪组织的形成。10注射之前,将藻酸盐氧化以改善其生物可降解性并使用碳二亚胺与整联蛋白结合肽(G4RGDASSKY)化学修饰以促进细胞粘附。10周后,含有人脂肪干细胞的水凝胶导致脂肪组织的形成(约50%初始凝胶体积),而阴性对照(无细胞的水凝胶)没有新的组织形成。除了透明质酸和藻酸盐之外,还可使用多种其他天然聚合物制备可注射水凝胶,包括壳聚糖,肝素,胶原蛋白,明胶,硫酸软骨素或这些的组合,用于软骨,骨骼和心脏组织再生。11
PEG由于其生物相容性和缺乏蛋白质结合位点,是制备可注射水凝胶使用最广泛的合成聚合物之一。PEG为引入调节与细胞相互作用的特定生物活性基团(如肽)提供了相对生物惰性的基础,且已被多种端基修饰,包括易于合成或购买的胺、硫醇、马来酰亚胺、丙烯酸酯和降冰片烯。12包括我们在内的几个研究小组已研发出用于细胞递送和组织再生的基于PEG的水凝胶。例如,Garcia等最近使用马来酰亚胺官能化的PEG大分子和硫醇官能化的肽(即半胱氨酸)形成用于细胞递送的可注射水凝胶。13这些水凝胶在封装过程中保持祖细胞(C2C12)(货号91031101)的活力,其交联时间范围基于聚合物浓度在1-5分钟之间,并促进细胞铺展。
控制水凝胶的形成和侵蚀的交联和降解反应
制备可注射水凝胶时必须仔细选择跟特定应用匹配的多种化学或物理交联策略。例如,合适的交联速率对于原位形成可注射水凝胶是十分重要的。若胶凝过慢,前体很可能从注射部位灌注到周围组织中,导致水凝胶性能差并引起未反应单体的炎症反应。若胶凝过快,则注射器中剪切可能变稀(且可能过早形成凝胶),引起网络缺陷,反过来又影响凝胶的力学性能和负载(即细胞)的保留/释放。此外,在活细胞中和治疗性蛋白存在下形成水凝胶的能力是细胞递送和再生医学应用的关键。下文将重点介绍一些最新实例相关的交联技术。
由于快速的交联动力学和高效率,点击化学是用于形成细胞递送的水凝胶中最有吸引力的交联化学类型之一。通常使用铜催化的炔烃-叠氮点击反应形成水凝胶;14然而铜有细胞毒性,因此限制了其在细胞封装和递送中的应用。为了克服这一问题,人们开始利用叠氮-烷烃的环化加成反应(SPAAC)交联细胞相容的水凝胶。 DeForest和Anseth报道了将叠氮-烷烃的环化加成反应用于水凝胶中的成纤维细胞的封装。15作者指出,当用二氟化环辛炔末端官能化的四臂聚乙二醇与叠氮化物官能化的肽交联剂反应时,环应变和吸电子氟取代基促进无催化剂的快速交联反应(约2分钟)。Dove等最新报道的另一种方法中叠氮化物官能化壳聚糖与丙酸官能化聚乙二醇在细胞中形成水凝胶的无催化剂反应。16该作者可以在水凝胶形成过程中封装间充质干细胞,且封装细胞在培养24小时后表现出高活力(> 95%)。这些包括巯基(特别是硫醇与马来酰亚胺或乙烯基砜的迈克尔加成),Diels-Alder反应、醛肼和肟反应和在内的和其他点击反应在可注射水凝胶中的应用十分有吸引力。关于化学交联反应的全面总结,读者可参考最近的综述文章。3,12,17
物理交联的可注射水凝胶使用离子、疏水、氢键或客体-主体互作形成,最常见的是通过热响应和离子相互作用。18Reis等报道了使用热响应聚(N-异丙基丙烯酰胺)-g-甲基纤维素(PNIPAAm-g-MC)形成应用于软骨组织工程的可注射水凝胶。19PNIPAAmg- MC聚合物的热响应相变形成了水凝胶,其较低的临界溶解温度(约32°C)。封装的ATDC5成软骨细胞呈圆形,支持软骨细胞表型修复,这对于关节软骨再生至关重要。使用离子相互作用的物理交联广泛用于交联多糖如藻酸盐及壳聚糖。例如,徐等将人脐带间充质干细胞(hUCMSCs)封装于基于藻酸盐的可注射水凝胶中应用于骨骼组织工程。20藻酸盐通过与钙交联实现凝胶化,二价阳离子存在时人脐带间充质干细胞具有约70%封装后活力。
对于所有的细胞递送和组织再生应用,注射后的水凝胶必须以受控的方式降解以达到期望的治疗用途(如细胞释放或浸润,蛋白质加工)而不产生细胞毒性降解副产物。通常可使用可切割的聚合物主链或动态/可逆交联实现降解。如前所述,透明质酸和藻酸盐等天然高分子在体内发生酶促水解,成为水凝胶降解的机制之一。对于合成聚合物,水凝胶用酯键如聚(乳酸)传统工程化,用于在根据加入的酯的数量预先设计的含水微环境中通过酯水解降解。此外,有几个研究小组还探索出更多响应式或触发式的可降解化学物质,包括光降解21、retro Michael22和Diels-Alder反应23,用于精确控制原位材料降解。最近,我们与Kiick研究小组合作,通过采用这些化学物质的两种或多种降解模式,实现了对用硫代 - 马来酰亚胺化学形成的可注射水凝胶的降解精确控制。24多个时间段的水凝胶降解是通过引入:i)经历光降解的邻硝基苄基醚键(k ~ 10–1 min–1对应365 nm ;10–2 min–1对应400–500 nm);ii)在谷胱甘肽(k ~ 10–3 min–1)存在时进行retro Michael型反应的基于芳基- 醇的琥珀酰亚胺硫醚键;iii)在含水微环境中进行酯水解的酯键(k ~ 10–4 min–1)。原则上,具有多模态降解性的这种可注射水凝胶可用于递送或募集细胞,其凝胶降解和组织再生的释放曲线精确可控。
原位形成水凝胶的细胞递送和组织再生
可注射水凝胶已被用于递送各种货物分子,包括生长因子、趋化因子和治疗细胞以促进体外和体内组织再生。这些原位形成材料被用于多种组织的再生,包括骨骼、软骨、椎间盘、脂肪、心脏和血管组织。本文重点介绍了一些应用于骨骼,软骨和心脏组织再生的可注射水凝胶的最新实例。最新的一篇综述文章论述了这个新兴研究领域的全面回顾。25
骨骼
解决骨缺损和异常是骨科的关键挑战之一。 Hubbell等的开创性研究表明,使用可注射水凝胶的骨组织工程方法是一种有吸引力的传统治疗替代方法,如自体骨植入和骨移植材料。26Song等最近的研究了使用可注射热敏感聚(磷腈)水凝胶持续递送骨塑型蛋白-2(BMP-2)(货号H4791)。27聚(磷腈)的额外羧基可促进其与骨塑型蛋白-2的离子相互作用,于注射时形成水凝胶,当温度接近生理温度(37℃)时发生凝胶化。C2C12细胞(货号91031101)在体外从这种水凝胶中释放骨塑型蛋白-2的延长超过20天,并分泌更多的骨钙蛋白(~14 ng/mL),对照组(~2 ng/mL),表明其保留了骨塑型蛋白-2对成骨细胞分化的生物活性。体内注射载有骨塑型蛋白-2的水凝胶导致小鼠异位骨形成,显示出可注射水凝胶用于骨再生的希望。
软骨
由于软骨组织的自愈能力有限,已有多种手术治疗方法促进软骨再生。其中,使用可注射或原位形成水凝胶在软骨缺损部位递送生长因子和治疗细胞是一种新兴方法。28Jin等报道了使用葡聚糖和透明质酸形成的用于软骨组织工程的可注射和可生物降解的水凝胶。在辣根过氧化物酶(货号77332)和过氧化氢(H2O2,货号H3410)存在时使用酚基团的氧化偶联实现水凝胶的快速形成(约2分钟)。牛软骨细胞在封装过程中保持高细胞活力(约95%),并且在21天内表现出糖胺聚糖和胶原蛋白产量增加。对于这些类型的修复,手术是接触组织部位的必要条件。因此,使用其他能够原位快速触发凝胶形成的反应性化学物质(如光聚合的甲基丙烯酸酯或巯基烯系统29),是非均匀缺陷位点组织再生研究的活跃领域。这种原位形成的水凝胶有望用于修复软骨缺陷。
心血管组织
心血管疾病是另一个应用可注射水凝胶提供有效治疗挑战性领域。为了解决慢性心肌梗塞相关的难题,Park等研发出使用丙烯酸化透明质酸和含巯基基质金属蛋白酶敏感肽交联剂的巯基水凝胶来调节组织再生的细胞活性。30具体来说,在心肌梗塞修复中起关键作用的趋化因子基质源生因子-1(SDF-1)(货号SRP3253和SRP3276),Ac-SDKP(刺激内皮细胞增殖和血管生成的肽)被掺入水凝胶前体溶液中。当注入心肌梗塞模型中的心外膜后形成载有蛋白的水凝胶,并于4周后评估心脏功能。这类评估结果表明注射SDF-1和SDKP载药的水凝胶改善了心室功能,增加了血管生成,减少了梗塞面积(SDF-1/ SDKP约8%,对照约41%),梗塞区域内壁厚增加(与对照相比高211%)。这些结果表明可注射水凝胶对于调节细胞功能,包括内源性细胞及组织再生的作用。
结论
过去的十年中,可注射水凝胶已经成为用于促进组织再生的细胞递送或募集的有前途的生物材料。在设计形成水凝胶的基础聚合物和交联化学物质以及用于水凝胶降解的可裂解和可逆化学物质(在细胞和组织的存在下)方面已经取得重大进展。这些方法保持了递送治疗细胞和生物制剂的生物活性,并促进了再生组织质量和功能改善。
致谢
作者非常感谢来自美国卫生研究院、Burroughs惠康基金和特拉华大学研究基金会的美国国家普通医学研究所(NIGMS P20GM104316-02)的资助,及特拉华COBRE项目的相关工作。我们感谢威斯康星大学麦迪逊分校生物化学系的MediaLab使用的Adobe Illustrator模板。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?