聚甘油癸二酸酯在组织工程和再生医学的应用
简介
商业生物材料已停滞不前超过30年的时间,因为很少有材料能够成功地从实验台过渡到临床使用。合成型脂族聚酯因其悠久的历史和获得美国食品药品监督管理局(FDA)批准的记录,一直在可吸收生物材料领域占据主导地位。尽管进行了大量的研究用于开发生物相容性、可生物降解的聚合物,但新的生物材料已受到合规性不匹配的影响,即未能成功模仿天然组织的机械特性。为了解决这些问题,Robert Langer教授的实验室开发了聚癸二酸甘油酯(PGS)作为一种坚韧、可生物降解的弹性体。1 从此发现以来,生物医学工程界已经在心血管、神经血管、整形外科和软组织领域的多个可植入应用中使用了PGS。2
PGS是一种简单的甘油酯聚合物,由基本哺乳动物代谢产物甘油和癸二酸制成,这两者都具有FDA的监管背景。1 PGS最初设计为具有改善的弹性机械性能和生物相容性的可生物降解聚合物,但基于PGS的医学应用的研究发现了其许多独特的性质,这些性质巩固了其作为生物材料的实用性。除了弹性外,PGS表现出极小的溶胀,且可通过表面降解并在体内表现出轻微的急性和慢性炎症反应 。虽然大多数研究人员选用热固性弹性体形式的PGS,但聚合物也可通过连续的树脂形式进行定制。根据聚合度不同,PGS可以制成柔软的凝胶、类似凡士林®的润滑糊状物、热塑性塑料或热固性塑料,其选择具体取决于应用。通过操纵各种形态,PGS还可以配制成一系列医用植入物的涂层,并挤压成管腔结构、片材、棒状和其他几何形状。此外,该聚合物与许多生物材料相容,例如胶原蛋白、骨矿物质和细胞外基质(ECM)样组合物,进一步使其成为组织工程、再生医学应用和生物医学设备工业的理想生物可吸收材料。
聚甘油癸二酸酯
设计与结构
目前人们对用于组织工程的生物弹性材料的兴趣在很大程度上取决于对软组织修复的需求。PGS专门用于动态机械环境(如心血管系统)中的工程软组织。1 该聚合物由甘油和癸二酸通过缩聚制成,聚合物主链中的酯键共价交联形成无规卷曲的三维(3D)网络,其类似于硫化橡胶的结构,并能够产生橡胶状弹性(图1)。羟基之间的氢键相互作用进一步增强了PGS的机械性能。由于聚合物主链和交联都是通过酯键构成,因此都可以进行水解降解。
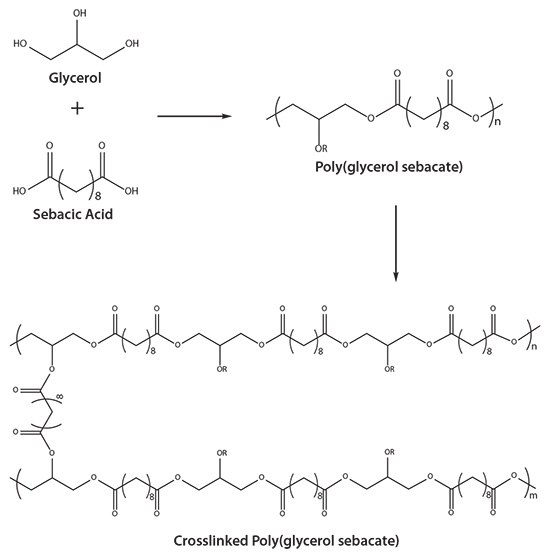
图 1.聚甘油癸二酸酯的反应示意图。PGS由甘油和癸二酸合成,并在加热和真空下进一步固化,以产生交联的PGS热固性树脂。
合成与力学性能
PGS通过甘油和癸二酸之间的缩聚反应合成,首先形成预聚物树脂,然后将其转化为热固性弹性材料。具体而言,两种原料都很便宜并且可以从可再生资源中获得;例如,癸二酸衍生自蓖麻油。3 PGS的合成还利用环境友好的化学而无需有毒溶剂或催化剂,从而通过整体可持续的方法产生合成生物材料。目前文献中已报道几种合成路线,但这里仅描述了最常用的两步法。首先向反应器中加入单体并在N2的覆盖下加热至120℃。在形成均匀溶液后,将混合物进一步加热24小时。然后根据所需的聚合度将反应器置于真空(40毫托-10托)下另外24-48小时。此时,树脂或预聚物已合成完成,并准备好进行第二步 - 产生热固性弹性材料。树脂可以作为浇铸薄膜使用,以模塑成特定形状,或在溶剂中还原以用于浇铸或浸涂相关的应用。根据弹性材料所需的机械性能,将树脂固化24-96小时。
PGS的一个优点是能够通过对聚合和固化过程进行微小的改变来调节其机械性能。弹性材料的模量值与交联度直接相关,范围为0.77-1.9MPa,分别固化48和96小时。通过改变单体化学计量来实现更宽的模量值窗口,其中模量值可以在0.01-5MPa范围内进行调节。改变单体化学计量也包括微调分子量和游离化学官能度。平均分子量值范围为2,000至> 200,000Da,同时也可以通过改变甘油:癸二酸的比例进行简单地调节。化学官能度(通过酸值滴定测量)可在110-10mg /g范围内进行改变,从而使得PGS具有不同的亲水性和弹性体的反应性。
降解性和生物相容性
PGS主要通过酯键水解成较小的低聚物并最终降解为起始单体甘油和癸二酸而进行降解。PGS降解过程非常独特并且不同于其它可再吸收的聚合物(例如,聚丙交酯、聚乙交酯和共聚物),因为PGS是通过表面侵蚀而不是整体侵蚀而进行降解的。4 与会导致机械性能显著降低的整体侵蚀形成对比,随着时间的推移,PGS的降解与机械性能损失表现出线性曲线。许多研究已经对PGS的体外降解进行了评估,以希望模拟其体内降解性能。但是,体外和体内的降解行为之间存在非常差的相关性。在体外一系列条件下进行的研究表明,通常在30天时会显示出超过20%的质量损失,而在皮下组织中则观察到70%的质量损失。4b 尽管PGS在体内比在体外模型条件下表现出加速的降解动力学相关,但可以通过固化时间和温度对交联密度进行调节,从而进一步调节降解速率。5
PGS可水解降解为其组分单体,甘油和癸二酸,是一种具有高生物相容性的可再吸收材料。甘油是脂质的代谢组成部分,并且在药物中具有长期使用历史。癸二酸是中链和长链脂肪酸ω-氧化过程的天然代谢中间体。此外,含有癸二酸的共聚物已被用于化疗药物的递送。6 各种研究已对PGS在体外分析和体内植入的相关研究中的生物相容性进行了评估。PGS已在体外显示出非细胞毒性1并且可能由于PGS的表面降解行为而诱导最小的炎症反应且几乎没有纤维囊的形成。7
在组织工程和再生医学的应用
组织工程在过去三十年中发展迅速,该领域创新的推动力部分来自于新型可生物降解弹性生物材料。8 所有身体组织在一定程度上具有固有的弹性,并且由于天然和工程构造之间的机械性质不匹配,许多植入物/移植物表现出部分失效。9 对于用于与血管组织接口的材料,基底弹性和机械刺激显著影响细胞功能和组织发育。10 因此,弹性材料被认为是用于血管组织和其他软组织再生应用的一类重要的支架材料。
在心血管组织中的应用
机械性能是选择心血管应用中使用的材料的特别重要的标准。由于PGS显示出很小的塑性变形,使得其对工程心血管组织十分具有吸引力。小直径动脉移植物仍然是组织工程中的主要挑战,高度多孔的PGS支架在小动脉工程化中表现出优良的效果。11 此外,内皮祖细胞和平滑肌细胞(SMC)能在PGS上进行良好的粘附和增殖。11d 在PGS支架中培养的SMC可共表达弹性蛋白和胶原蛋白,有助于获得高度顺应的工程化血管。11c 此外,虽然这些细胞制备的原弹性蛋白的量在PGS和PLGA支架上是相同的,但弹性PGS底物允许原弹性蛋白交联成锁链素交联的弹性蛋白。11b 在大鼠腹主动脉模型中,由用聚己内酯纳米纤维鞘增强的PGS管组成的复合动脉移植物在3个月内显示移植物进入到新动脉的建设性重塑阶段。12 这一新动脉从机械、生物化学和解剖学上模仿了天然动脉,并且新动脉能与宿主脉管系统很好地进行整合。值得注意的是,该新动脉能与宿主动脉同步脉动。植入一年后,新动脉包含与其天然对应动脉具有相同量的弹性蛋白,并在新动脉的外膜中再生(图2)。13

图 2.新动脉的大体形态和组织结构类似于天然动脉。A) 左上:在一年的过程中将移植物在原位转化为新动脉。不可降解的缝线(黑色)标志着移植物的位置。右上:外植体的横向视图类似于原生动脉。底部:外植动脉的纵向视图类似于相邻的原生动脉。所有标尺刻度均为1毫米。B) 新动脉中部的横切面H&E染色显示出与天然主动脉相似的组织结构,没有可见的移植材料残留物。比例尺为100毫米。C)新血管切片von Willebrand因子(vWF,红色)和 α- 肌肉肌动蛋白(α-SMA,绿色)免疫染色。新动脉的腔表面完全被vWF阳性细胞(红色)覆盖,表明其与内皮细胞融合。新动脉包含血管壁的介质样中间层,表现为丰富的具有周向细长细胞核的α-SMA阳性细胞,其类似于天然主动脉中发现的血管平滑肌结构。新动脉的最外层α-SMA含量较少,类似于天然的外膜结构。介质样层中的一些细胞是α-SMA阴性的,与内皮相邻的一些细胞是α-SMA阳性的,但不表现出周向拉长。比例尺为100毫米。 L表示血管腔。细胞核DAPI染色(蓝色)。D)新动脉腔表面的 正面 视图显示CD31阳性细胞的完全覆盖,且具有鹅卵石样形态和平行于血流方向的排列,这种排列与天然主动脉中发现的排列形式类似。将新动脉纵向切开并使用共聚焦显微镜和z-堆叠展平对全样品进行成像。箭头表示血流方向。比例尺为100毫米。经参考文献13许可转载。版权所有2013,Elsevier Ltd.
由于PGS的机械性质易于调节以容易地匹配心肌组织,PGS还广泛应用于心脏组织工程中14。5 在一个应用案例中,PGS用于制造具有平行通道的高度多孔支架,其能够模拟天然心肌中发现的毛细血管网络。14c 在具有氧载体的灌注生物反应器中心脏成纤维细胞和心肌细胞的共培养物在11天内产生了可收缩的构建体。14d 当放置于体内时,无细胞PGS支架在植入梗塞的大鼠心肌模型后2周内发生血管化。14d 最近,研究人员构建出类似手风琴的蜂窝状微结构的PGS支架(图3)。14a 其硬度可由固化时间控制,从而匹配大鼠右心室心肌的力学性质。另外,PGS支架已经预涂有ECM蛋白,从而提供了增加细胞相互作用的配体,这一改变可增加细胞性、增强ECM蛋白产生、并调节内皮祖细胞的分化。15
在神经组织中的应用
PGS还被证明具有作为神经再生的支架材料的应用前景。7 研究人员已在体外和体内系统地对PGS的神经生物相容性进行了评估。在体外,原代施旺细胞在PGS和PLGA表面上显示出相似的附着率和代谢活性 。PGS上的细胞比PLGA上的细胞具有更高的增殖率和更低的凋亡活性。体内与坐骨神经并置的植入显示PGS引起明显低于PLGA的慢性炎症反应,其可能原因是PGS的最小溶胀和表面侵蚀的特性。最近的一项研究对用于视网膜祖细胞(RPC)移植的微制造PGS多孔支架进行了探究。该支架的杨氏模量为1.66}0.23MPa,最大应变率为113±22%。16 与用于RPC递送的传统PLA/PLGA共混物(杨氏模量为9.0±1.7MPa,最大应变率为9%)相比,该支架的机械性能更接近视网膜组织(杨氏模量为0.1MPa,最大应变率为83%)。该体外研究表明,RPC能在PGS支架上粘附并增殖良好,并显示出分化的趋势。视网膜下的移植证明了长期的RPC存活和高水平的RPC向宿主视网膜组织的迁移。17

图 3.手风琴式蜂窝状支架能够产生类似于天然心肌的各向异性机械性质。A,B) 该示意图显示由两个重叠的200×200 μm2方格以45°旋转的角度(菱形)构成的手风琴式蜂窝设计。对应于心脏的周向轴和纵向轴的优选(PD)和正交交叉优选(XD)材料方向已在图中进行标识。比例尺:1 mm(A)和200 μm(B)。C)扫描电子显微照片显示准分子激光微烧蚀在PGS手风琴式蜂窝设计中的保真度。比例尺:200μm。D)让PGS固化时间系统性的发生变化,在测试范围内,PGS有效刚度相对于固化时间呈线性依赖性(EPGS)。E)带有培养的新生大鼠心脏细胞的手风琴式蜂窝状支架的代表性单轴应力-应变率图(支架由PGS膜制成,在160 ℃下固化7.5小时;新生大鼠心脏细胞培养1周)。经参考文献19许可转载。版权所有2008,Nature Publishing Group。
在骨骼组织中的应用
虽然骨骼是硬组织,但它是从胚胎期的软胶原组织发展而来的。与此类似,天然骨愈合过程也是从称为愈伤组织的柔软临时组织开始的。因此,可以使用由PGS弹性材料制成的支架来治愈无法愈合的骨缺损。为此,使用多孔PGS管对兔模型中完全横切的尺骨的两端进行连接。18 愈合从形成类似于愈伤组织的软骨组织开始,通过微CT检查在2个月内,其逐渐矿化并完全桥接缺损。结果显示,较低刚度的PGS弹性材料可以产生负荷转换环境,在此环境中能够更有效地进行骨再生。相反,传统的金属植入物可能引起骨的应力屏蔽,使得愈合更加困难。
在医用纺织品涂层中的应用
由于涂层技术提供了一种改进底层衬底和提高器件性能的方法,因此其在医疗器械开发中起着重要作用。PGS作为涂料在该领域显示出巨大的应用前景;其树脂易于在各种溶剂(例如乙酸乙酯、THF、丙酮、1,3-二氧戊环和各种醇)中被还原,从而得到可用于浸涂和喷涂应用的溶液。图4显示了一系列涂有光滑适形PGS薄膜的纺织基材(PET、聚丙烯、PGA和镍钛合金)。增强的机械性能、改进的生物相容性和抗微生物性能是PGS涂层所赋予的特征,说明其在医疗设备领域中的实用性。

图 4.覆盖于一系列常用的医疗器械纺织组件上Regenerez涂层的SEM图像:A)浸涂聚对苯二甲酸乙二醇酯的编织物, B)浸涂聚乙醇酸的针织品, C)浸涂PEEK的网状物, D)喷涂镍钛合金的编织物,以及E)浸涂聚丙烯的网状物。SEM图像由Secant Group的Carissa Smoot提供。
结论
由于对能够模仿天然组织特性的材料的不断追求,生物材料将继续在医疗器械和再生医学中发挥重要作用。PGS具有多种特性,使其成为满足设备和组织工程应用中许多技术要求的理想材料。在过去的15年中,PGS已被应用于心血管、神经、软组织和硬组织等领域,并且今天仍在寻找新的用途(例如用于植入设备的涂层)。在这段时间内,PGS已经从研究实验室发展到商业化,并推出了Regenerez®聚甘油癸二酸酯树脂。如本文所述,最近的研究进展肯定会扩展这种多功能生物材料的实用性和应用。
材料
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?