作为智能药物递送系统的刺激响应材料
材料科学已经彻底改变了药物递送的中心范式,特别是癌症治疗学。现在,人们可以通过定制递送系统的物理化学性质来开发实现治疗性分子的按需递送,也就是所谓的智能系统。药物递送材料设计上的许多进展都来自于人们对肿瘤微环境的日益了解,同时也受到了肿瘤生物环境细微差异研究进展的启发。癌症是一种涉及许多不同细胞类型、细胞外基质、免疫因子、信号传导分子和生理现象的复杂疾病。涉及癌症的细胞类型具有显著多样性,对于药物靶向治疗肿瘤提出了重大挑战。现有化学疗法的多药耐药性(MDR)进一步加重了这个问题,不可避免地导致临床结果不佳。肿瘤微环境也具有显著的多样性,其具有多种特征,包括肿瘤血管异常、淋巴引流不畅、缺氧、低pH梯度、氧化还原环境、高间质压力和高蛋白酶活性等。1在细胞水平上,肿瘤不仅包括肿瘤细胞,还包括基质细胞、内皮细胞、免疫细胞成分和癌症干细胞(CSCs)等多种群体。2肿瘤内的这些异质性为肿瘤带来了生存优势并促进肿瘤生长,也有助于疾病向远处的进一步发展和传播。相反,人们也可以使用智能聚合物系统来刺激肿瘤生理学中的细微差异,从而能够设计具有肿瘤特异性的治疗策略。
内部调控系统
内部调控载体(也称为自我调控或闭环系统)会对来自体内的刺激产生响应,比如pH、氧化还原、蛋白酶的存在或其他因子,从而调节药物的释放。病变部位生物环境的改变会引起递送系统的化学或物理变化,从而实现有效载荷的释放。释放曲线完全取决于疾病部位的生理状态,不能从外部调控。
pH响应系统
pH响应系统利用pH的显著变化来刺激局部药物递送到身体的不同区域,例如胃肠道、肿瘤微环境或细胞的内体/溶酶体区室(图1)。癌细胞喜欢选择有氧糖酵解作为其主要能量来源,不受氧浓度影响。这会使得乳酸盐在肿瘤微环境中发生积聚,从而导致细胞外基质中的pH降低。这种现象通常被称为“沃伯格(Warburg)效应”。这不仅满足了快速分裂癌细胞对能量的不断需求,而且为其他大分子生物合成提供了必需的前体。4pH响应载体在设计时通常使用含有可离子化弱酸或弱碱的聚合物,以利用酸性微环境来控制药物递送到肿瘤中。这些材料取决于通过质子化和去质子化在含水介质中的选择性溶解。比如丙烯酸(AAc)(货号147230)、甲基丙烯酸(MAAc)(货号155721)、马来酸酐(MA)(货号M188)、甲基丙烯酸N,N-二甲基氨基乙酯,DMAEMA)和2-(甲基丙烯酰氧基)乙基磷酸二氢酯,都是已经开发得到的弱酸及其衍生物的一些实例,而聚(酰氨基胺)(PAA或PAMAM)是一种已广泛用于设计pH响应递送载体的常见聚合物弱碱实例。聚(β-氨基酯)(PbAE)是另一种具有强pH依赖性溶解性的聚合物, PbAE也被用于设计pH响应递送系统。人们对pH响应性聚环氧乙烷-PbAE(PEO-PbAE)共聚物系统的全面体外和体内研究表明:在MDA-MB-231乳腺癌细胞中,其具有较高程度的细胞凋亡率,可以有效地在SKOV3人卵巢癌异种移植模型中发生累积。5–7人们已经发现有数种pH响应载体适用于递送生物制剂,如基因、siRNA、miRNA、肽和蛋白质,这证明了递送系统的多功能性。8,9
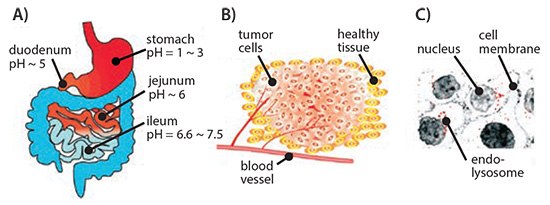
图 1.器官(A)、组织(B)和细胞(C)水平内不同pH环境的示意图,可利用其开发pH响应药物递送系统。转载自参考文献8,经美国化学学会2010年许可。
氧化还原响应系统
肿瘤表现出特征性氧化性细胞外和还原性细胞内环境,产生氧化还原电位,其是氧化还原响应递送载体开发的驱动力。与细胞外基(2–20 μM)相比,谷胱甘肽三肽的胞质和细胞核浓度(2–10 mM)要明显更高,氧化还原响应系统有可能会失去其结构完整性。由于该响应性,二硫键(S–S)是研究最多的氧化还原敏感键,其可以用于开发基于聚合物、脂质或蛋白质的递送系统。例如PEG-SS-聚(ε-己内酯)(PEG-S-S-PCL)、PCL-SS-聚(磷酸乙乙酯)(PCL-S-S-PEEP)、SS-PAA-g-PEG或葡聚糖-SS-PCL等一类壳可摒弃的共聚物,其都已被成功用作具有更快药物递送动力学的氧化还原响应递送系统。有效载荷的体外活性和优异的体内肿瘤生长抑制作用证实了这一改进。10我们的研究团队开发了一种硫醇化明胶基蛋白纳米粒子系统,在携带肿瘤异种移植物的胰腺人类腺癌中,该系统在针对胰腺癌细胞的靶向递送小分子和基因方面具有很高的能力。11在另一项研究中,在这些纳米颗粒上加载了质粒血管内皮生长因子(VEGF-1),其在原位MDA-MB-231人乳腺癌模型中,实现了肿瘤生长减少以及血管生成。12还采用逐层(LbL)组装方法,将涂覆在二氧化硅纳米粒子上的聚(乙烯吡咯烷酮)(PVP)(货号81430)用作牺牲模板以形成二硫化物交联聚(甲基丙烯酸)(PMA)胶囊,用于递送蛋白质和肽作为疫苗和小分子抗癌药物。10
酶响应系统
蛋白酶是肿瘤生理学的组成部分。诸如基质金属蛋白酶(MMP)、组织蛋白酶和尿激酶纤溶酶原激活物(uPA)等癌症相关蛋白酶(CAP)在肿瘤组织重塑,以及疾病发展、侵袭和传播中起着至关重要的作用。人们已经证明,MMP在大多数癌症中存在过度表达,并且通常被认为是癌症发展和侵袭性的重要原因。13因此,人们设计了一类酶响应载体,其含有酶特异性肽,以便在底物被肿瘤内的酶活性降解后实现药物递送。此类特别设计的酶响应载体的实例包括:通过应用蛋白酶敏感基质,实现局部递送化疗药物,随后将缀合在蛋白酶可切割肽CGLDD上的顺铂进一步结合在PEG-二丙烯酸酯水凝胶晶片上。该方法可以对MMP-2或MMP-9的存在做出响应,实现药物的及时释放。葡聚糖-PVGLIG-甲氨蝶呤缀合物显示出与MMP相似的释放药物反应,并在体内表现出肿瘤抑制作用。141,2-二油酰-sn-甘油-3-磷酸乙醇胺(DOPE)(货号 76548)、乙酰化二肽(N-Ac-AA)、二油酰三甲基丙烷(DOTAP)和磷脂酰乙醇胺(PE)一起用于制造非弹性脂质体,其可以在被弹性蛋白酶或蛋白酶K活化时转化为融合蛋白,从而改善细胞内的摄取。14
在类似的方法中,人们将蛋白酶响应性连接基团(例如GPLGIAGQ)、用PEG官能化的DOPE与二硬脂酰磷脂酰胆碱(DSPC)、胆甾醇氯甲酸酯和胆甾烯-5-基氧基-N-(4-((-亚氨基-2 -,β-D-硫代半乳糖基乙基)氨基)丁基)甲酰胺(Gal-C4-Chol)混合,以制备表面具有半乳糖的脂质体,用于肝细胞靶向给药。这些半乳糖部分被成组PEG基团屏蔽,限制了摄取。然而,在MMP-2存在的情况下,将PEG连接到脂质体表面的肽会被切割,靶向配体暴露,从而促进了快速摄取。14在最近的研究中,人们将含有肽GSGRSAGK(含有uPA的共有序列)的胆固醇锚定接枝聚合物和丙烯酸同时用在使用1,2-二油酰-sn-甘油-3-磷酸胆碱(DOPC,货号P6354),1,2-二棕榈酰-sn-甘油-3-磷酸胆碱磷酸胆碱(DPPC,货号P0763)和胆固醇(分别为47.5:5:47.5)制成的脂质体中(图2A)。这些含有交联聚合物的脂质体显示出更好的稳定性,可以抵抗渗透性溶胀或渗漏。在酶的存在下,交联迅速降解,使得药物通过脂质体溶胀而释放(图2B)。15尽管这些纳米载体的临床应用还没有建立,但临床前研究表明,这些体系在增加药物疗效方面具有巨大的前景,目前这些药物的生物利用度普遍较差。
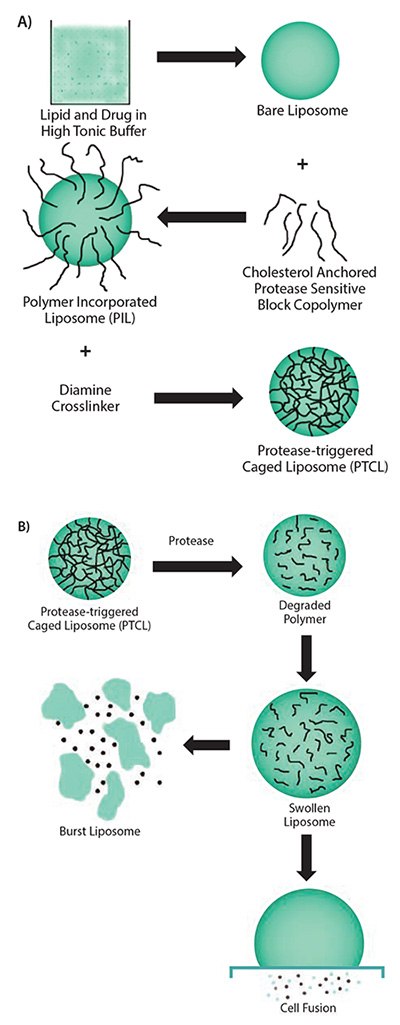
图 2.A) uPA敏感聚合物笼式脂质体合成方案中所涉及的多个步骤。B) 针对酶存在响应所提出的聚合物笼式脂质体行为机制。转载自参考文献15,经美国化学学会2011年许可。
外部调控系统
外部调控系统也称为开环系统,是一种药物递送能力可由来自体外的刺激进行控制的载体。由于人们可以精确控制外部刺激的持续时间和强度,因此可以在时间和空间上对这些纳米载体的药物释放曲线进行控制,以实现按照所需剂量、按需供应药物。人们研究范围包括:热、光、声、磁和电刺激,讨论如下。
热响应系统
热响应材料会在低于或高于特定温度下经历相变。该变化分别被称为低或高临界溶解温度(LCST或UCST)。此类材料在临界温度以上或以下是不溶的,但在到达转变温度时,会变成完全可溶的形式。聚(N-异丙基丙烯酰胺)(PNIPAAm)就属于此类聚合物材料,其对于药物递送应用来说并不理想。PNIPAAm在与生理条件类似的32°C的水温下会变成疏水性。然而,通过改变侧链、聚合物的分子量、聚合物结构或将其与其它亲水性或疏水性聚合物进行共聚,能够定制转变温度以适合生物医学应用。因此,PNIPAAm衍生物作为热敏药物递送载体的材料已得到了广泛研究,并且已用在了胶束、脂质体、水凝胶和纳米凝胶、聚合物囊泡、互穿网络、膜和无机纳米粒子的表面。16PNIPAAm与聚(N,N二乙基丙烯酰胺)(PDEAAm)、聚(N-乙烯基己内酯)(PVCL)、PLGA、聚[2-(二甲基氨基)乙基甲基丙烯酸酯](PDMAEMA)、PEG、明胶和壳聚糖的共聚物已用在了化疗药物和生物制剂当中。除了药物递送之外,人们还大量开发用于其他应用的热敏材料,包括用于组织生长和工程、成像和诊断的表面和支架。17
光响应系统
由于光的强度和穿透深度可以实现精确控制,因此其是一种受欢迎的外部刺激选择。因此,光敏材料作为药物递送系统变得越来越流行。偶氮苯、邻硝基苯、香豆素和芘衍生物均常用于光响应药物递送载体设计。Jiang等人开发了一种含有聚环氧乙烷(PEO)和聚(甲基丙烯酸酯)(包括芘侧链作为二嵌段共聚物)的紫外响应胶束体系。作者使用尼罗红染料(货号19123)作为替代品,证明该体系中有效载荷的释放是辐射时间和照明功率的函数。18然而,紫外线照射不利于生物学应用,特别是长时间照射。为此,人们正在开发对可见光或NIR波长敏感的替代材料。无机纳米材料,特别是各向异性贵金属纳米粒子,表现出了优异的NIR吸收特性,已被用作吸光材料以促进药物递送。Kang等人使用在850nm附近具有强吸收最大值的硅金涂层纳米棒作为模板,在纳米粒子表面上对丙烯酰胺进行聚合交联。此类负载了阿霉素(DOX)的颗粒在用NIR光(808nm)照射时表现出增强细胞毒性,但是在纳米颗粒没有经过照射或者在没有纳米颗粒时经照射的情况下显示出很小的作用。这些结果证实了光介导载荷释放的存在。18Hribar等人采用类似的方法,开发了一种聚合物-金纳米棒复合材料,在用NIR光照射时可以控制和精确释放小分子(<800 Da)。通过将PbAE大分子单体(A6)、丙烯酸叔丁酯(tBA)单体和2-羟基乙酯丙烯酸(分别为10:20:70%w / w)进行聚合形成聚合物共混物,然后将高浓度的金纳米棒和光响应材料加载到聚合物微粒核中(图3A–4C)。负载DOX的体外释放强烈依赖于光照(激光ON)(图3D),由于光诱导的药物释放,其在T6-17细胞中的毒性增加(图3E)。19
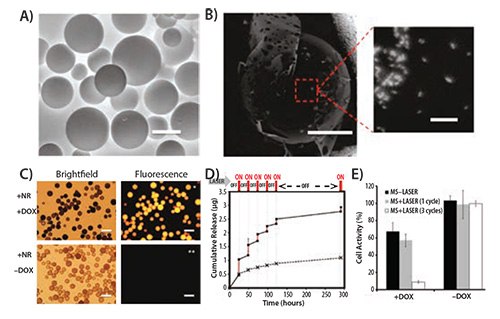
图 3.A) 由A6:HEA:tBA (10:20:70)制成的聚合物微球(MS)的环境扫描电子显微照片。比例尺为50 μm。B) 上有嵌入金纳米棒(亮点,比例尺=20μm)的微球的反向散射显微照片,突出区域的放大图像中是微球内的纳米棒(比例尺= 200nm)。C) 微球的明场和荧光图像。载有DOX的微球具有强烈的荧光(上图,右),而没有DOX的微球无任何背景荧光(下图,右)。所有图像中的比例尺都是100μm。D) 作为生理温度(37℃)下激光脉冲(波长= 808nm)的函数,微球释放药物的累积曲线。E) MS和载有DOX的MS在激光下经过1和3个周期(激光功率= 1.1W,5分钟/周期)后,T6-17细胞活性的柱状图。转载自参考文献19,经美国化学学会2011年许可。
超声响应系统
超声能量如光的强度一样,可以根据需要定制强度,并聚焦在身体的一个小区域中。此设计可最大限度提高药物释放效率,因此其通常被称为高强度聚焦超声(HIFU)。由于其在临床成像和诊断中的广泛应用,基于超声的按需释药载体被视为开发“分泌”递送系统的天然材料。超声能量主要通过三种机制介导释放载体的药物释放:(1)发热,(2)声空化,(3)声辐射力。影响超声技术性能的一些重要参数包括应用的时间和性质。基于超声递送的基本原理很大程度上受到热量的调节,因此,基于超声递送的纳米粒子递送系统设计在组成上类似于热响应系统。微泡技术最初是为了增强超声成像的对比度而开发的,因此其已经被用于声空化以改变细胞渗透性,同时也被用作递送载体。20
Ibsen等人制备的嵌套脂质体采用通过在脂质体中产生微泡以实现超声响应性的方法,已证明其可用于递送小分子和大分子。与此类似,使用载有mRNA-脂质复合物的微泡作为疫苗已成功地在树突细胞中实现报道基因的转染和表达,从而实现了成熟度的轻微改变,进而诱导T细胞反应。21因此,超声辅助递送是一种具有巨大潜力、非常具有吸引力的方法。
磁性调控系统
像热响应和超声响应载体一样,响应于磁场的递送系统依赖于高温诱导来释放有效载荷。可以通过施加外部磁场来将这些载体引导和集中在身体特定区域的能力给该递送系统带来了额外优势。以往,多将超顺磁性氧化铁纳米粒子(SPIONs)一类的磁性纳米粒子结合在聚合物、脂质或蛋白质递送系统中以赋予它们磁性。SPIONs也广泛用作磁共振成像(MRI)造影剂,其在递送载体中的存在可以提供具有刺激响应性的成像模式。用热响应性聚合物PNIPAAm涂覆且负载有DOX的SPION由于磁场诱导高温而在高于临界溶解温度(LCST)时表现出快速的药物释放,在LCST以下表现为缓慢持续释放。植入肝细胞癌的Buffalo大鼠的体内研究揭示了磁性引导在肿瘤中的积累和药物释放性得到了增加。从而改善了基于对比的MR成像和治疗潜力的有效性。22Majewski等人展示了磁活性载体作为基因递送系统的实用性。最重要的是,该研究表明内化磁性纳米颗粒可以用于从群体中选择性分离转染细胞。23由于磁性调控递送系统具有附加多功能性,其现在经常用于设计双重和多重刺激响应,以实现独立刺激反应的优势。24
电响应系统
某些材料(有机和无机)具有导电性,可用于设计对外部电场有响应的递送系统。用于药物递送的电敏材料常见例子包括聚吡咯(PPy,货号577030)、二茂铁和碳纳米管。在此类应用中通常使用弱电脉冲(〜1V),由于以下数个优点,电场要优于其它外部施加刺激:电脉冲(1)易于控制和应用,(2)不需要复杂和精密仪器,(3)可以很容易地集成在基于芯片的设备设计中。 Ge等人制备了十二烷基三甲基溴化铵(DTAB)胶束,以癸醇为助表面活性剂,将PPy在疏水核上聚合。然后将这些纳米颗粒加载在具有温度依赖性、溶胶-凝胶转变的热敏PLGA-PEG-PLGA嵌段聚合物上。该聚合物在4℃下以溶液形式存在,但在37℃的生理温度下会迅速形成凝胶。随后将柔红霉素和荧光素加载到包埋在聚合物基质中的纳米颗粒中。所得材料在体温下保持固体水凝胶形式,并显示出电脉冲依赖性药物释放。将其在可溶形式下通过皮下注射注入FVB小鼠体内,会迅速形成凝胶,并且在施加电脉冲时在体内成功地释放有效载荷。在对照组中,因为没有外部刺激导致负载释放量不大。25Zhu等人采用一种新方法,将4-(3-氰基苯基)丁烯(CPB)作为电场活性“纳米叶轮”接枝到介孔二氧化硅的壁上。由于其具有较大的固有偶极矩,接枝的CPB在施加电场的作用下发生重新取向。随后 CPB从孔隙中迅速释放出客体分子(布洛芬)。26
未来展望
关于刺激响应递送系统的大量现有文献表明,这些系统正在变得越来越重要。然而,这些系统中的大多数还没有完成临床前阶段,目前只有少数例子已经进入临床试验阶段。27人们对精确控制“应对”应用“刺激”的需求使得临床转化充满了挑战。复杂的合成步骤和多个组分配方进一步加重了这个问题。大多数刺激反应性递送系统仍处于开发的早期阶段,在进入临床环境之前需要对合成过程进行优化。在从临床前到临床水平这一过程中,刺激的准确性和精确度也需要改善。外部施加的“物理”刺激很容易控制和操纵,但内部“生物”触发不容易控制。肿瘤在不同患者、器官,或甚至相同肿瘤之间的生理状态都会显示出相当大的变化。另一方面,需要改进外部刺激以实现更好的组织穿透而不造成任何损害,这将需要优化数个相关参数。
其他因素也可能对刺激响应载体的递送系统产生负面影响。导致递送载体在肿瘤中发生累积的EPR效应在临床前研究中是一种公认的现象,但在临床上尚未得到证实。另外,大多数疾病表现出由病变细胞、组织间质、免疫细胞和组织其他结构细胞所组成的复杂微环境,这限制了递送系统接近目标靶细胞的能力。这些物理和生理障碍进一步阻碍了递送系统实现最佳性能。在癌症中,细胞和生理水平的异质性显著限制了这些载体进入其靶标的能力。大多数研究的刺激响应系统都已经在体外进行了测试,但很少有体内应用,这是需要立即关注的一个方面。人们的目标是设计具有积极刺激响应特性的简化系统。这一成功将大大提高临床应用的机会。尽管还有几个主要的障碍尚未克服,但是刺激响应系统已经显示出巨大的前景,可以作为现有递送方式的替代方案。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?