DNA寡核苷酸合成
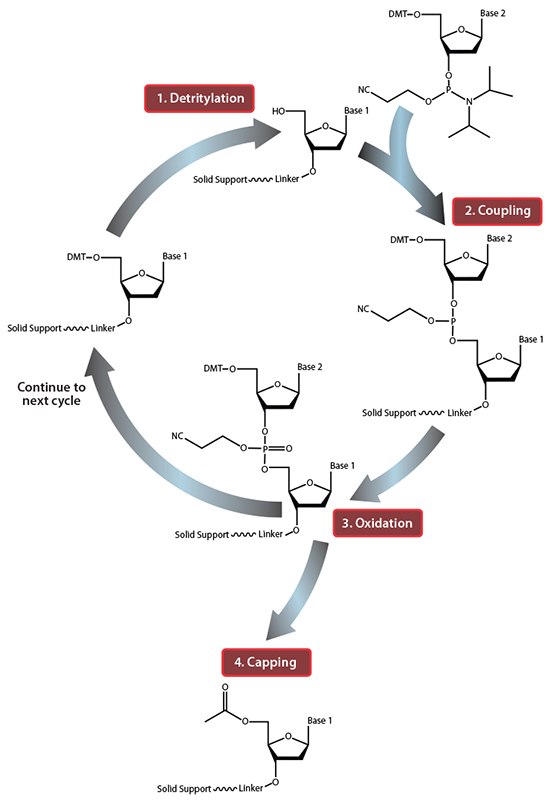
图 1.固相寡核苷酸合成循环一览。 在步骤1“脱三苯甲基化”中,5'-DMT保护基团从第一个固相支持物连接的核苷中除去。在步骤2“偶联”中,第一个固相支持物连接的核苷的游离5'-OH攻击进入的第二核苷的磷,置换其二异丙基氨基基团。在步骤3“氧化”中,不稳定的亚磷酸三酯被转化为稳定的磷酸三酯,这允许开始下一循环,在步骤1中进行第二个核苷的脱三苯甲基化。然而,在进入下一个循环之前,在步骤4“加帽”中,将具有未反应的5'-OH的固体支持物连接的核苷乙酰化,从而防止具有缺失突变的序列延长(在氧化后进行加帽以驱除所有的水,否则会抑制下一个反应循环)。
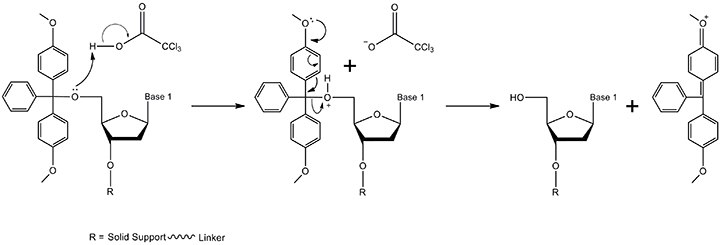
图 2.脱三苯甲基化机制。5'-DMT保护基团通过TCA(三氯乙酸)在溶剂二氯甲烷中除去(太浓缩的TCA溶液或太长的脱三苯甲基化时间会导致脱嘌呤,因而会降低最终寡核苷酸的总产率)。产物包括具有游离5'-OH和DMT碳阳离子的3'末端核苷(通过图中未显示的电子离域形成的共振结构)。核苷在合成中进行到步骤2,而DMT碳阳离子在495nm处吸收,从而产生可用于监测偶联效率的橙色。
步骤2(偶联)
一旦除去DMT,固相支持物连接的核苷的游离5'-OH能够与下一个核苷反应,其以亚磷酰胺单体加入。该机制如图3所示。
![偶联机制。溶剂乙腈中进入的亚磷酰胺单体的二异丙基氨基基团被酸性催化剂ETT [5-(乙硫基)-1H-四唑] “活化”(质子化)。当试剂被输送到固相支持物时,在合成仪的流体管线中进行混合。活化的亚磷酰胺以多倍于固相支持物连接的核苷的量加入,以使反应尽可能接近完成。产物包括具有亚磷酸三酯键的二核苷和游离的二异丙氨基基团。 偶联机制](/deepweb/assets/sigmaaldrich/marketing/global/images/technical-documents/articles/genomics/pcr/dna-figure-3/dna-figure-3.jpg)
图 3.偶联机制。溶剂乙腈中进入的亚磷酰胺单体的二异丙基氨基基团被酸性催化剂ETT [5-(乙硫基)-1H-四唑] “活化”(质子化)。当试剂被输送到固相支持物时,在合成仪的流体管线中进行混合。活化的亚磷酰胺以多倍于固相支持物连接的核苷的量加入,以使反应尽可能接近完成。产物包括具有亚磷酸三酯键的二核苷和游离的二异丙氨基基团。
步骤3(氧化)
在偶联反应过程中形成的亚磷酸三酯是不天然且不稳定的;因此,必须在下一个循环开始之前将其转化为更稳定的磷物种。氧化将亚磷酸三酯转化为稳定的磷酸三酯。该机制如图4所示。
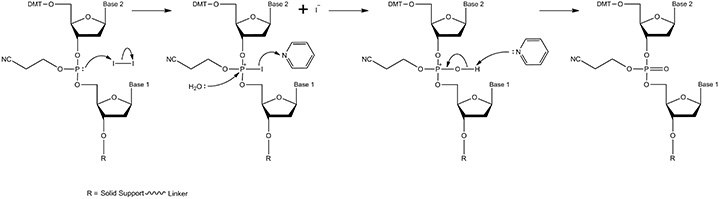
图 4.氧化机制。在水和吡啶存在下用碘实现亚磷酸三酯的氧化。产物是磷酸三酯,其基本上是标准DNA骨架,在游离氧上具有β-氰乙基保护基团。
步骤4(加帽)
由于100%的偶联效率是不可能的,因此总会存在一些与未反应的5'-OH连接的固相支持物连接的核苷。如果没有被封闭,这些羟基基团将在下一个循环中反应,从而导致缺失碱基。由连续循环积累起来的这些缺失突变将产生难以纯化的“短链”的复杂混合物,因此可能使寡核苷酸在随后的应用中无用。需要进行加帽步骤以防积累短链。该机制如图5所示。
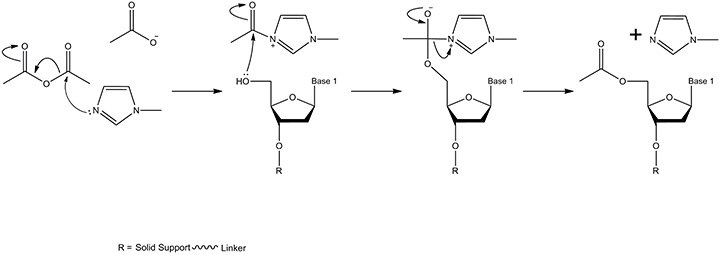
图 5.加帽机制。乙酸酐和N-甲基咪唑反应,在含有少量吡啶的溶剂四氢呋喃中形成中间体。当试剂被输送到固相支持物时,在合成仪的流体管线中进行混合。产物是固相支持物连接的核苷,其具有乙酰化的5'-OH(吡啶保持碱性pH,从而防止游离乙酸盐/乙酸使亚磷酰胺单体脱三苯甲基化)。
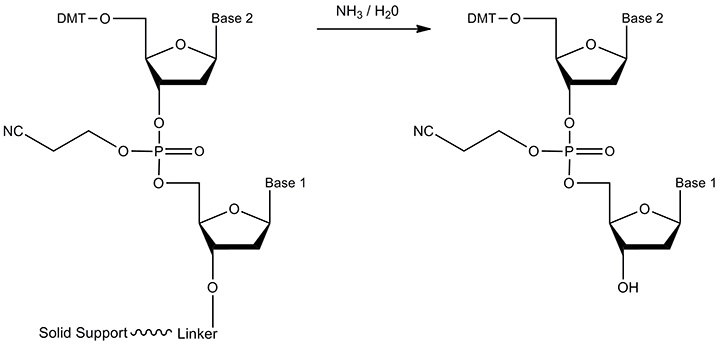
图 6.切割的反应物和产物。通过用浓氨水处理来进行接头的酯水解(同时除去固相支持物)。产物是具有游离3'-OH末端的寡核苷酸。
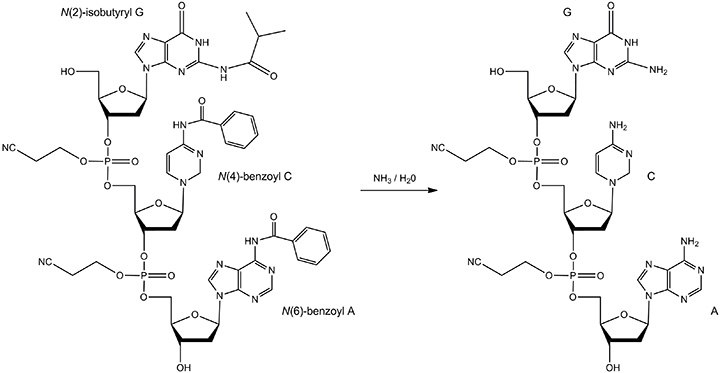
图 7.碱脱保护的反应物和产物。加热寡核苷酸浓氨水溶液。保护基团包括:N(6)-苯甲酰基A,N(4)-苯甲酰基C和N(2)-异丁酰基G。反应产物是完全去保护的A、C和G碱基。
除了标准保护基团之外,不稳定的二甲基甲酰胺基G和“超温和”保护基团可用于对氨敏感的修饰寡核苷酸。相关碱基上的这些保护基团如图8所示。
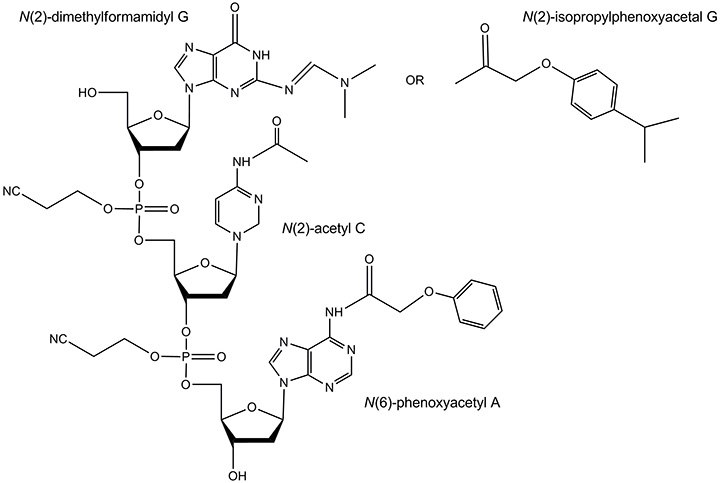
图 8.不稳定的和超温和的保护基团。 二甲基甲酰胺基保护基团通常通过加热在浓氨水中除去,但是比异丁酰基的时间短得多。超温和保护基团包括:N(6)-苯氧基乙酰基A,N(2)-乙酰基C和N(2)-异丙基苯氧基乙酰基G。它们通常在室温下在浓氨水 / 甲胺溶液中除去。
磷酸二酯的形成
必须除去磷酸盐游离氧上的β-氰乙基基团,以将其从磷酸三酯转化为磷酸二酯。该机制如图9所示。
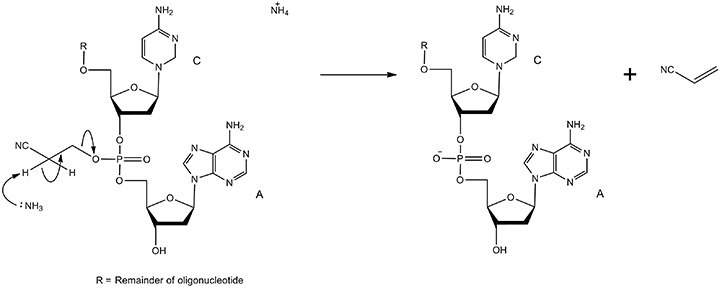
图 9.通过去保护形成磷酸二酯的机制。用β-消除法在浓氨水中除去氰乙基基团。这个反应很快,因为与吸电子氰基相邻的碳上的氢原子是高度酸性的。产物是具有天然磷酸二酯骨架和丙烯腈的寡核苷酸。
重要的是要记住,偶联效率并不是决定产率的全部因素。脱保护、切割和纯化(甚至简单的脱盐)都会进一步降低产率。我们担保的产率基于此处提供的生产规模和纯化方式。
如要继续阅读,请登录或创建帐户。
暂无帐户?