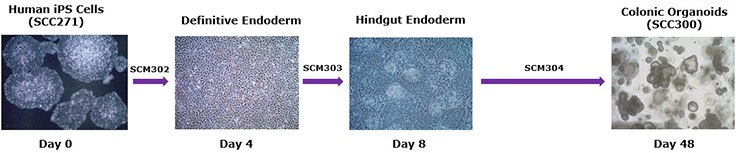
通过无血清细胞培养条件将人多能诱导干细胞(iPS)体外分化为结肠类器官
类器官(organoid)是复杂的自组织三维细胞培养模型,通常由干细胞发育而来。1目前构建的类器官取材于各种组织,包括脑、2肠、3胃、4结肠、5肝、6胰、6肺、7肾8和患者来源肿瘤。9肠上皮类器官,通常称为类肠(enteroid)或迷你肠(mini-gut),保留胃肠道系统的生理特性,作为有效的细胞培养工具已用于建模研究肠道发育和肠道疾病,包括结肠癌、乳糜泻病、炎症性肠病和宿主-微生物组相互作用。10Clevers等开发的传统分离培养技术1需要进行长时间的肠道原代组织分离培养,且取材于小鼠或难于获取的人类组织样本。而诱导多能干细胞(iPSC)来源的类器官可通过来源更广阔的人类供体快速构建患者特异性细胞模型。我们现建立了人iPSC来源结肠类器官体系,提供已检测的高度表征的冻存人结肠类器官和扩增培养基。另提供优化的无血清培养基和试剂,可通过简单的三阶段分化流程将任意的人iPS细胞系分化为结肠类器官。
类器官培养方案
第1阶段:人iPS细胞分化为定型内胚层(第0-4天)
注意:起始材料采用高质量的未分化人ES/iPS细胞(SCC271),融合度约70-80%,分化细胞比<5%。下列方案用于组织培养处理过的6孔培养板的1个孔分化。方案体积为单孔用量,请根据需要调整体积。
- 配制单细胞传代培养基。将ROCK抑制剂(ROCKi)Y-27632(SCM075)加入7-10 mL 人ES/iPS扩增培养基(SCM130),终浓度为10 µM。
- 用ECM凝胶(CC131-5ML)包被6孔板。
- 吸去液体。用2 mL DMEM/F12培养基或1X PBS洗涤孔。吸去液体,向孔中加入1 mL Accumax™解离液(A7089)。37̣ °C孵育5-6分钟。在手掌上大力拍打板子,使细胞松脱。
- 向孔中加入1 mL单细胞传代培养基(步骤1配制)。用5 mL移液管上下吹打1-3次,分散细胞。小心不要引入任何气泡。
- 将分离后的细胞收集到15 mL锥形管中。向孔中加入单细胞传代培养基,收集残留细胞继续转入上述含细胞悬液的15 mL锥形管中。140 x g离心5分钟管子,弃上清。
- 加入1 mL单细胞传代培养基,重悬细胞沉淀。 用台盼蓝(T8154)和细胞计数板计数活细胞。
- 向ECM凝胶(CC131-5ML)包被的6孔板每孔加入1x106细胞。使用单细胞传代培养基(步骤1配制);总体积 = 3 mL/孔。37 °C过夜培养。
- 吸除孔中液体。向孔中加入2 mL定型内胚层诱导培养基(SCM302),37 °C过夜培养。
- 第2天和第3天重复步骤8。第4天通过流式细胞术分析细胞。进行第2阶段前,细胞应呈内胚层标志物CXCR4、c-Kit、Sox-17和FOXA2阳性(>85%),PDGFR阴性。
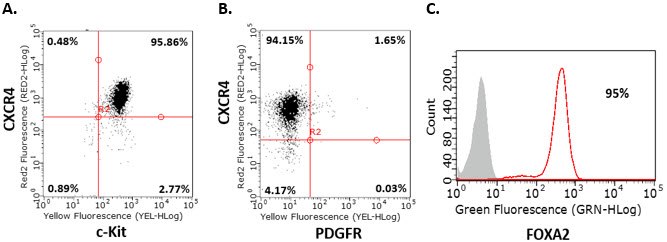
图 2.人iPS细胞的内胚层分化。对人iPSC来源定型内胚层细胞进行内胚层标志物的流式细胞分析,表明经过4天分化的细胞呈CXCR4+、c-Kit+、Sox-17+、PDGFR-和FOXA2+表型。
第2阶段:后肠内胚层分化(第4-8天)
- 从培养箱取出含第4天定型内胚层培养物的6孔板。
- 吸去每孔液体。
- 每孔用3 mL 1X PBS洗涤。
- 每孔加入2 mL预热的后肠诱导培养基(SCM303)。
- 加好后,马上将培养板放入培养箱37 °C、5% CO2培养24小时。
- 重复2-5步,共计培养5天。
- 后肠内胚层分化的第5天是关键的时间点,需检测CDX2表达。 CDX2表达必须>60%,才能进行第3阶段。假如CDX2表达低于60%,将后肠内胚层多分化一天,再次检测CDX2表达。
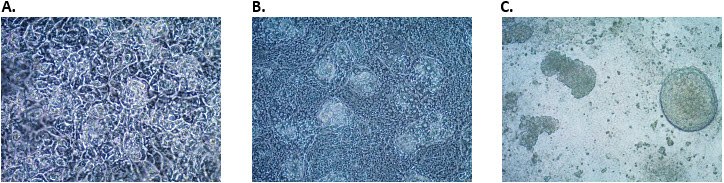
图 3.定型内胚层细胞分化为后肠内胚层细胞。后肠内胚层诱导后第2天(A),第3天(B)和第4天(C)的后肠内胚层细胞形态。
第 3 阶段:结肠类器官的扩增和冻存(第8-48天)
结肠类器官的扩增
- 从培养箱取出含第8天后肠内胚层培养物的6孔板。
- 吸去每孔液体。
- 每孔用3 mL 1X PBS洗涤。
- 每孔加入2 mL预热的3dGRO™人结肠类器官扩增培养基(SCM304)。
- 加好后,立即将培养板放入培养箱,37 °C、5% CO2下培养48小时。
- 每两天更换新的3dGRO™人结肠类器官扩增培养基(SCM304),直到分化第12天。
注意:第12天末会形成结肠球状体,需使用Matrigel®基质胶包埋,加入3dGRO™人结肠类器官扩增培养基(SCM304)获得成熟的结肠类器官。
- 添加终浓度10 µM的ROCKi Y-27632(SCM075)至人结肠类器官扩增培养基(SCM304)。
- 4 °C过夜或在冰上解冻充足的生长因子减量版Matrigel基质胶。
- 在结肠上皮细胞分化的第12天,取出培养箱细胞,将培养基中悬浮的球状体收集至15 mL锥形管中。
- 每孔用3 mL 1X PBS洗涤。
- 加入1 mL Accumax解离液(A7089)解离含球状体的单层细胞(非悬浮球状体),37 °C孵育5-10分钟。
- 单层松散后,用P-1000移液器温和吹吸细胞4-5次,将获得的1 mL细胞悬液继续转入第9步的锥形管中。
- 4 °C下265 x g离心5分钟。
- 吸去上清,用4 mL 1X PBS洗涤1次。
- 4 °C下265 x g离心5分钟,吸去上清。
- 轻弹锥形管底部,松散沉淀。
- 在超净台(TC hood)中放好Matrigel®基质胶,快速取1 mL加入步骤16的松散细胞团中。
- 用P-1000移液器(设为900 µL)温和重悬Matrigel®基质胶中的细胞团块。重悬时勿制造气泡。
- 立即将细胞悬液在冰上放置5分钟,防止凝固。
- 用新鲜的Matrigel®基质胶按1:50-1:100稀释1 mL Matrigel®基质胶/细胞悬液,并按50 µL/dome加入24孔培养板各孔(例如,如要进行1:100稀释,每10 µL基质胶/细胞悬液与40 µL新鲜基质胶混合,50 µL/孔铺板)。见图4。
- 立即将24孔板在37 °C下培养10分钟。
- dome(基质胶半球状液滴)凝固后,加入1 mL 3dGRO™人结肠类器官扩增培养基(SCM304)+ 10 µM ROCKi (SCM075)。
- 每两天更换1 mL新的3dGRO™人结肠类器官扩增培养基(SCM304)。
- 每10-12天用3dGRO™类器官传代消化液(SCM300)传代类器官,分割比例为1:3至1:4。

图 4.人结肠类器官。A)解冻后2天,结肠类器官包埋在Matrigel®基质胶dome中。B)培养第10-12天,结肠类器官占据dome的85-90%,可以传代。
结肠类器官的冻存
人结肠类器官可使用3dGRO™类器官冻存液(SCM301)冻存。该冻存方案在人结肠类器官冻存传代过程中不使用任何解离试剂。建议每管冻存4个dome,每个dome密度为90%。如密度低于90%,每管冻存更多dome。
- 当类器官可用于冻存传代时,从培养箱中取出培养板。
- 用P-1000移液枪上下吹吸现有的1 mL液体5次,重悬Matrigel基质胶。
- 将获得的类器官悬液转入锥形管。
- 用10 mL移液枪沿锥形管壁吹吸10次,继续打散类器官。
- 265 x g至700 x g离心锥形管。
- 吸去上清,用1 mL 1X PBS重悬沉淀。
- 用P-1000移液枪吹吸20次,打散类器官团块。
- 在类器官悬液中加入5 mL 1X PBS,4 °C下700 x g离心5分钟。如上清中残留类器官碎片,多离心5分钟。
- 吸去上清,用1 mL 3dGRO™类器官冻存液(SCM301)重悬沉淀。
- 用P-1000移液枪吹吸重悬沉淀5次,按4 dome/管添加冻存液,分装冻存管。
- 将含有细胞的冻存管放入冻存盒(例如Mr. Frosty梯度降温盒),在-80 °C冰箱放置24-72小时。
- 将冻存的人结肠类器官放入液氮罐长期储存。
结果
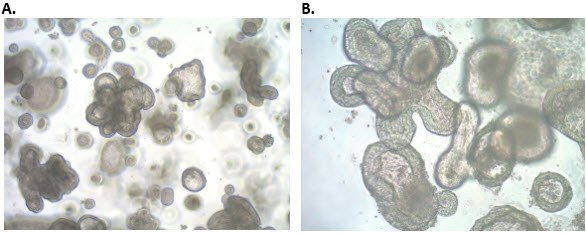
图 5.人iPS细胞来源结肠类器官的形态。成熟的人结肠类器官三维培养后呈现复杂形态。A) 4倍放大 B) 10倍放大。
CDX2
CA-IV/DAPI
黏蛋白-5B/DAPI
黏蛋白-2/F-肌动蛋白/DAPI
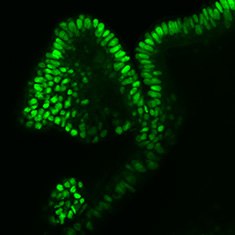
CDX2
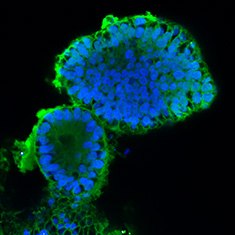
CA-II/DAPI
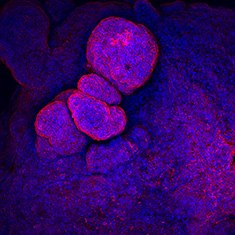
CA-IV/DAPI
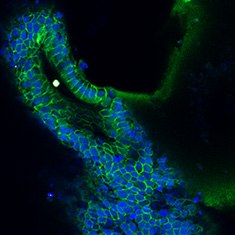
黏蛋白-5B/DAPI
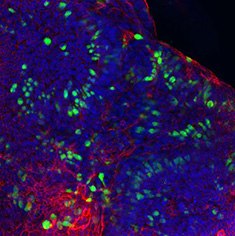
黏蛋白-2/F-肌动蛋白/DAPI
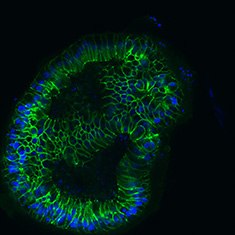
E-Cad/DAPI
图 6.人结肠类器官的免疫细胞化学分析(ICC)特性。人iPS细胞来源结肠类器官呈CDX2、α-碳酸酐酶II、α-碳酸酐酶IV、黏蛋白-5B、黏蛋白-2和E-钙粘蛋白阳性。
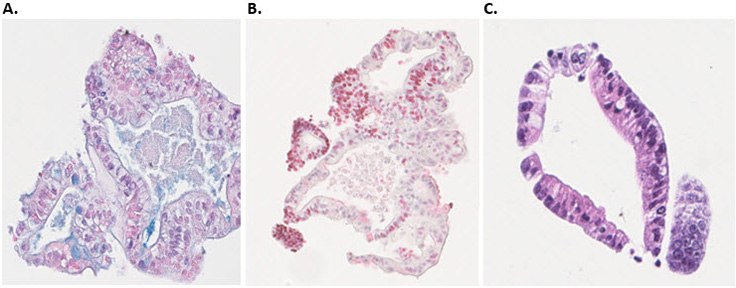
图 7.人结肠类器官的免疫组化分析(ICC)特性。A)阿尔新蓝染色鉴定杯状细胞 B)Ki67抗体(红色)鉴定增殖细胞 C)H&E染色鉴定细胞核与细胞质蛋白。
结论
我们建立了可靠的三阶段分化培养方案,成功通过人多能诱导干细胞(iPSC)制造人结肠类器官。获得的结肠类器官表达成熟的结肠标志物CDX2、α-碳酸酐酶II、α-碳酸酐酶IV、黏蛋白5B、黏蛋白2和E-钙粘蛋白,并可连续传代多次而不丧失结肠表型。我们的类器官和无血清培养基组合可提供充分验证的三维细胞新模型,用于药物发现的肠道疾病研究。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?