肿瘤干细胞成球实验方案

图 1.肿瘤成球实验方案概述
肿瘤成球实验方案
- 使用胰蛋白酶-EDTA 溶液 (T3924 ) 分离含有贴壁生长癌细胞系的肿瘤干细胞。细胞融合度应为80-90%,且状态良好。
- 以300 x g离心细胞悬液 5分钟并吸出上清液。将细胞重悬于少量培养物中,例如 3-5 mL 的 3dGRO™ 球状体培养基 ( S3077 )。
- 计数细胞 (PHCC20060),并用 3dGRO™ 球状体培养基调节其体积,以使浓度达到1X106个细胞/ml。
- 将细胞以1X104 个细胞/ml 的浓度接种于适当的悬浮培养容器中,例如,在Corning® Costar® 超低吸附多孔板 ( CLS3471 ) 的每个孔中接种 4 mL共含40,000 个细胞的3dGRO™ 球状体培养基。
- 根据使用的细胞类型,孵育培养物 4-10 天。每 3-4 天添加一半培养体积的新鲜 3dGRO™ 球状体培养基。不要像传统二维细胞培养一样一次性更换所有培养基。
- 在肿瘤球状体培养基开始形成深色中央区之前将其传代。根据所使用的细胞类型,最佳传代应在 4-10 天后完成。
- 用血清移液管将细胞和培养基转移到 15 mL 锥形管,采集肿瘤球状体。
- 让肿瘤球状体在室温下重力沉降 10分钟。吸出上清液,但在锥形管中保留约 200μl。注意不要吸出肿瘤球状体。
- 用等体积PBS (D8662) 重复步骤 7-8。轻轻吸出 PBS,在锥形管中留下约 200μl。
- 向肿瘤球状体中加入 1 mL 胰蛋白酶-EDTA ( T3924 ) 溶液,室温反应 2–4分钟。每 30 秒上下移液一次,使肿瘤球状体重悬于胰蛋白酶溶液中。避免肿瘤球状体沉降。
注意:用户必须根据经验确定完全解离每种细胞所需的最佳反应时间。虽然在大多数情况下 2-3分钟最佳,但某类细胞的肿瘤球状体,例如 MCF-7,可能需要更长的反应时间——特别是在传代多次以后。如果您青睐完全明确的解离过程,可根据供应商的说明使用重组胰蛋白酶 ( T3449 ) 溶液作为替代解离试剂。 - 用 1000μl 移液管上下吹打肿瘤球状体 10-20 次,以生成单细胞悬液。正常吸出细胞悬液,但在排出细胞时,将吸管尖端在管底略微倾斜。产生的剪切力可促进所有残余细胞聚集体分解。进行肉眼检查,确认无大细胞聚集体残留。研磨后立即加入两倍体积的胰蛋白酶中和溶液 ( T6414 ) 或培养基。
注意:不要过度研磨,以免影响细胞活力。通过 40 μm 细胞过滤器过滤细胞悬液,可以除去未解离的细胞聚集体。 - 测定细胞数量和活力。以300 xg 离心细胞 5分钟。弃去上清液,将细胞以1X106个细胞/ml的密度重悬于新鲜的 3dGRO™ 球状体培养基中。
- 在全新的 Corning® Costar® 超低吸附多孔板 ( CLS3471 ) 上以 1X104 个细胞/ml 的密度重新接种细胞。通常情况下,6 孔板每孔加入 4 mL 共含4X104个细胞的培养基 。
典型结果
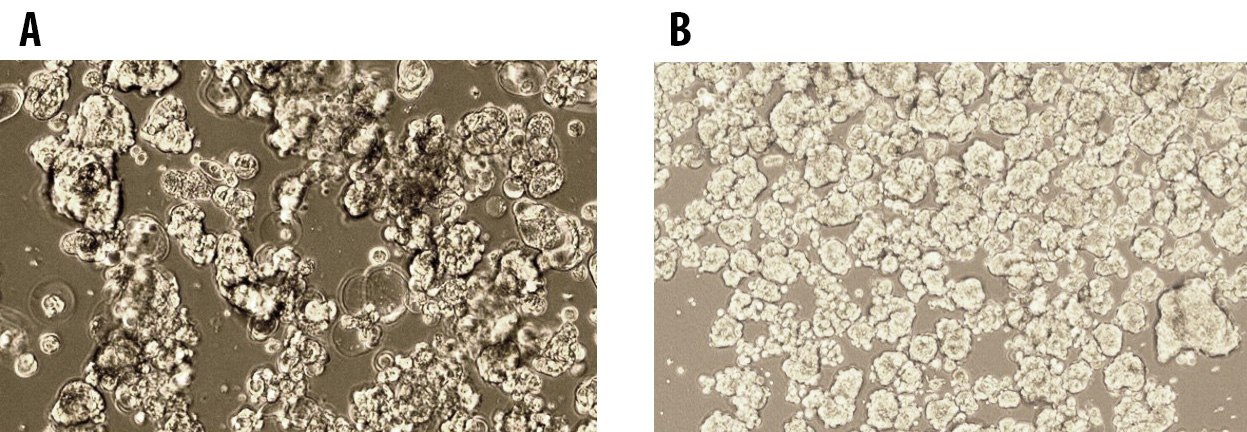
图 1.在 3dGRO™ 球状体培养基中培养的第 1 代 (A) 和第 5 代 (B) MCF7 乳腺癌细胞的肿瘤成球
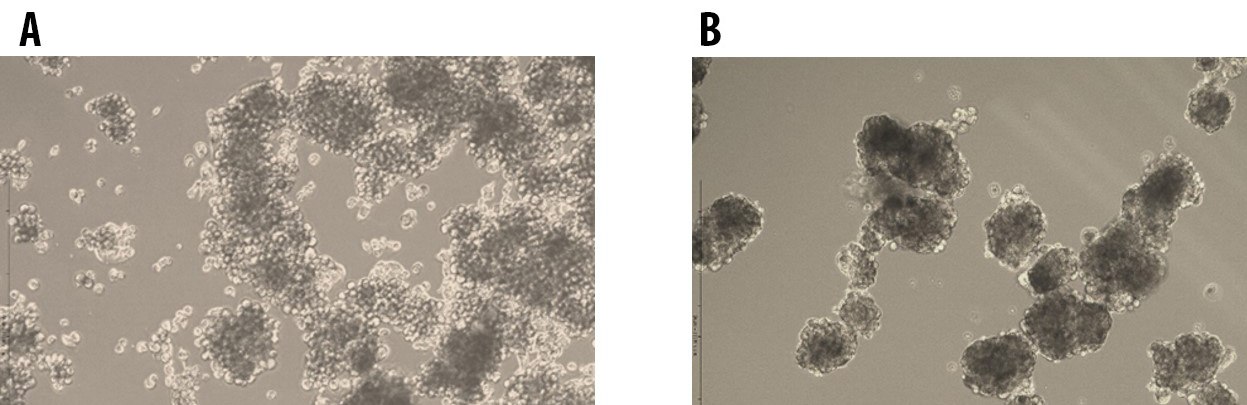
图 2.在 3dGRO™ 球状体培养基中培养的第 1 代 (A) 和第 5 代 (B) E006AA 前列腺癌细胞的肿瘤成球。
材料
Loading
登录以继续。
如要继续阅读,请登录或创建帐户。
暂无帐户?