Cultrex® 96孔3D球体BME细胞侵袭测定实验方案
I. 产品描述
96孔3D球体BME细胞侵袭检测方法以标准化、三维、高含量的形式,在体外对侵袭细胞响应化学引诱物和/或抑制化合物而穿透屏障(包括基底膜组分)的程度进行定量,这一过程也是血管生成1、胚胎发育2、免疫反应3、和肿瘤细胞转移4的基础。内皮细胞、上皮细胞、肌肉和神经元细胞与其相邻基质之间形成的连续的胞外基质层称为基底膜。它们不仅支撑着细胞和细胞层,还通过影响细胞粘附、迁移、增殖和分化对组织形成产生重要作用。基底膜在发育和伤口修复过程中被降解和再生,并且它们是转移性肿瘤细胞侵袭的主要屏障。目前最常用的通过基底膜屏障来评估细胞侵袭的方法是Boyden室方法,例如Cultrex®BME细胞侵袭检测。该方法的确是一种快速、简便和定量的方法。然而,在显微镜下观察侵袭是非常困难的,并且该测定以单细胞悬液开始,其可能忽略掉转移过程中的早期步骤,例如初始上皮至间充质转换(EMT)。
对更完整和在生理条件下预测癌症侵袭模型的需求推动了96孔3D球体BME细胞侵袭检测的发展。越来越多的证据表明,肿瘤细胞聚集体或球状体更能代表体内肿瘤,它们具有多种生理特征,包括相似的形态、细胞-细胞键的形成、增殖率降低、细胞存活率增加、肿瘤休眠以及一个缺氧的核心5-8。将该模型应用于3D培养物侵袭检测中,提供了用于评估肿瘤侵袭的更生理学的方法,并提供了可通过图像进行分析定量的视觉组分。
该96孔3D球体BME细胞侵袭检测试剂盒利用符合3D培养要求的96孔球状体形成平板以及专门的球状体形成ECM来促进细胞的聚集和球状体形成。在球状体形成完成后,球状体嵌入由基底膜蛋白组成的侵袭基质中。该基质形成水凝胶网络,侵袭的细胞可在其上行进。此时,可以将入侵调节剂应用于系统中以评估其对细胞反应的影响。细胞侵袭的过程可在显微镜下进行可视化,并可通过图像分析软件进行定量。
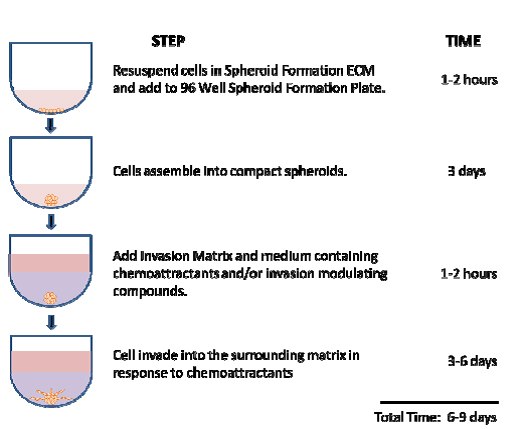
图 1.96孔3D球体BME细胞侵袭测定步骤
IV.注意事项和限制
- 仅供研究使用。不可用于诊断流程。
- 这些产品的物理、化学和毒理学性质尚不完全明确;因此,我们建议在处理这些化学试剂时穿戴手套、实验服和护目镜。
- CULTREX® 3D培养96孔BME侵袭检测试剂盒包含吞咽或与皮肤或眼睛接触可能有害的试剂。如果接触眼睛,立即用大量清水冲洗并就医仅限科研使用。
V.准备说明
- 10X Spheroid Formation ECM
10X Spheroid Formation ECM应当在4 ⁰C 冰上解冻并用组织培养生长培养基进行稀释后冷却到4⁰C;利用血清移液器上下吹打以进行混匀。细胞在1X 球状体形成 ECM中进行悬浮,并向符合3D 培养要求的96孔球状体形成平板的每孔中加入50 uL的细胞悬浮液。
有关推荐的稀释方案请见表1。
- 侵袭基质
侵袭基质应在4℃冰上进行融化,并轻轻倒转以形成均匀溶液。如果侵袭基质中有可见气泡,则在4 ⁰C条件下在浮桶式转头中300 x g离心5分钟。向预冷的用于3D培养的96孔球状体形成板的每个侵袭孔中加入50 μL未稀释的侵袭基质。
- 带有细胞侵袭调节成分的组织培养基
向组织培养基中加入2X浓度的侵袭调节成分来弥补球状体嵌入到侵袭基质中造成的总体积改变。组织培养基在加入到凝胶侵袭基质时必须保持37 ⁰C以维持凝胶属性。
VI.储存方法和稳定性
产品在手动除霜冰柜中–20 ⁰C条件下,自发货日期开始可稳定至少3个月。为获取最佳的稳定性,请将其储存在–80 ⁰C。避免反复冻融。
VII.检测实验方案
以下操作步骤应该在采用杀菌技术的生物学超净台中进行以防止污染。
A.细胞收集
根据制造商的建议进行细胞培养。建议采用以下程序并可能需要对其进行优化以适应所研究的细胞类型。
- 细胞在用于检测之前应当处于健康状态并保持增殖。细胞应当传代2至3次并通过台盼蓝或类似的方法对细胞活力进行评估。在细胞活力达到90%之前不要开始检测。
- 每孔大约需要2,000-5,000个细胞,而25及75 cm2培养瓶可分别产生至少1 x 106和3 x 106的细胞。请相应合理安排。
- 在收集前,对细胞进行观察并记录健康状态、相对数量及形态。
- 用无菌PBS或HBSS将细胞洗涤两次。每25 cm2培养瓶使用5 mL而每75 cm2培养瓶使用10 mL。
- 收集细胞。对于25 cm2及75 cm2的培养瓶,分别加入1 mL或2 mL细胞收集缓冲液(参见所需自备材料),并在37 ⁰C孵育5-15分钟直到细胞完全从培养瓶底部解离。
- 将细胞转移至15 mL锥形管中,并加入5 mL的细胞培养基。
- 将细胞200 x g离心3分钟形成沉淀,去除培养基并用2 mL的细胞培养基对细胞进行悬浮。可能需要血清移液器上下吹打细胞以重悬细胞并将细胞打散。在计数前对细胞进行目视观察以确认单细胞悬浮液的形成且没有发生细胞聚集。
- 对细胞计数并通过台盼蓝或其他类似检测对细胞活力进行评估。如果细胞活力低于90%,请勿开始测定。
- 在细胞培养基中将细胞稀释至每毫升1 x 106个细胞。
B. 96孔3D球体BME细胞侵袭测定步骤
- 检测准备 - 第0天之前
- 确定检测参数及适当的对照。适当的对照包括含或不含侵袭调节试剂的样品,以及含或不含侵袭基质的样品。
- 确定每种细胞系的最佳接种密度。通常可以从每孔3000开始。最佳的接种密度可以通过采用球状体形成方案(VII.B.2.)对球状体形成的尺寸分析后而进行预估。
- 按照制造商的建议对细胞进行培养;贴壁细胞应当培养至80%以下的融合度。
- 在4 ⁰C冰箱里进行10X 球状体形成ECM过夜冰上解冻。
- 球状体形成 - 第0天
- 按照VII章节中指导进行细胞收集并计数A.
- 在1X球状体形成ECM中进行单细胞悬浮液制备。参考V.1.章节进行试剂制备。
- 在符合3D培养要求的96孔球状体形成平板的每孔中的1X 球状体形成ECM中加入50 uL单细胞悬浮液。如果需要,利用每个板附带的条形密封,以保留未使用的孔便于后续实验。
- 在吊桶式转子中200 x g室温离心3分钟。
- 在组织培养箱中37 ⁰C孵育72小时以促进球状体的形成。
- 3D培养细胞侵袭 - 第3天
- 将用于3D培养的96孔球状体形成平板置于冰上15分钟以对孔进行冷却。
- 将孔板置于冰上,在用于3D培养的96孔球状体形成平板的每孔中加入50μL侵袭基质;见第V.2试剂准备章节。
- 将平板在浮桶式转子中300 x g,4⁰C离心5分钟,以消除气泡并将侵袭基质内的球状体定位在孔的中部。
注意:高速和/或长时间离心会对随后的球状体侵袭产生不利影响。 - 将平板转移至设定为37 ⁰C的组织培养箱中孵育一小时,以促进侵袭基质的凝胶形成。
- 一小时后,视需要加入100 uL含有化学引诱物和侵袭调节成分的预热(37⁰C)细胞培养基。可参考V.3章节进行试剂制备。
- 将平板在37 ⁰C组织培养箱中孵育3至6天,并使用4X物镜每24小时对每个孔中的球状体进行拍照。调整光照和焦距,以提供3D结构和背景之间最大的对比度。对表达荧光蛋白或具有荧光标记的细胞使用荧光显微镜也可以改善对比度和随后的分析。在处理过程中,碎片可能会转移到96孔板的底部;在拍摄之前用镜头纸擦拭孔的底部可以提高清晰度。如果需要,该测定可以进行超过6天;其终点通常是当结构大小开始超过分析领域或细胞开始过期时。
- 采用图像分析软件对图像进行分析以测量侵袭结构在面积上的改变,以确定每个样品的3D培养球状体扩张程度。
- 图像分析
注:图像可采用ImageJ (http://rsb.info.nih.gov/ij/)等免费软件进行分析,如下所示。其他图像分析软件也可通过配置以达到同样的测量目的;请向相应的软件供应商咨询相应的功能和使用方法- 采用4X物镜对已知尺寸(如1mm)进行拍摄并在ImageJ中进行像素测量
- 打开图片。进入File/Open并选择图片。
- 选择线工具。
- 画一条线长度的对象。
- 进入Analyze/Measure并记录像素数。
- 计算每mm的像素数(如600像素/mm)。记录结果------- 像素/mm。
- 选择标尺;该步骤在每次打开ImageJ后均进行
- 进入Analyze/Set Scale。
- 在“Distance in pixels”中输入VII.B.4.v中的值(上方)。
- 在“Know distance”中输入"1,000"。
- 在“Unit of Length”中输入“um”。
- 勾选“Globa”l并选择“OK”。
- 分析球状体图像。
- 打开图片。进入File/Open并选择图片。
- 转换成8字节图片: 进入Image/Type/8 bit(勾选)。
- 调整图片阈值。进入Image/Adjust/Threshold(勾选)。该程序将会对暗和明像素进行区分,而阈值则会通过滑动标尺而在柱状图上发生调整。相似的调整可同样适用于相同条件下拍摄的照片。暗像素的区域将会被红色覆盖。调整阈值使得仅有球状体图像被覆盖。
- 选择球状体。选择圆形工具并对图像进行环绕。这会使得球状体之外的任何暗像素从测量中去除。
- 进入Analyze/Measure。这会在表格中对球状体结构的面积(μM2)进行测量。在一张表中更可进行多重测量。保存表格。
- 将表格转换至Excel工作表中。打开Excel并“另存为”.xls或.xlsx文件。
- 采用4X物镜对已知尺寸(如1mm)进行拍摄并在ImageJ中进行像素测量

图 2.3D侵袭分析过程 A) 捕获图像并转换成8字节;B) 设置阈值以捕获整体的结构;C) 选择结果以计算总面积。
VIII.数据解读
1.Cultrex® 3D培养96孔BME侵袭检测提供细胞侵袭的形态学和定量分析。侵袭细胞从球状体突出到周围的基质中,形成纺锤状突起;然而,在没有侵袭基质的情况下未见突起(图3)。这导致侵袭细胞系在相对少量的时间内使表面积发生了大的变化,而这对于非侵袭性细胞系来说不会发生(图4)。可对这些表面积的变化进行测量并用于比较不同细胞系或经历基因操作的细胞系的相对侵袭能力。

图 3.四天内3D细胞侵袭的形态学分析。非侵袭性细胞(MCF-7)保持细胞聚集的状态并且不会侵袭周围的侵袭基质;然而,侵袭性细胞(MDA-MB-231)以纺锤状突起的形式侵入周围的侵袭基质。
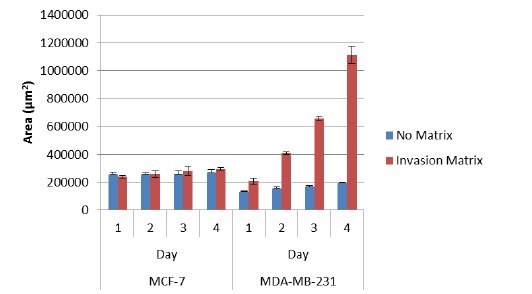
图 4.四天内非侵袭性(MCF-7)和侵袭性(MDA-MB-231)细胞系表面积的定量分析。
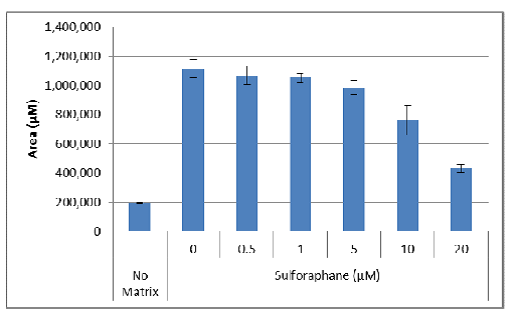
2.表面积的变化也可用于评估药理学化合物对3D细胞侵袭的影响。一旦建立了最佳测定条件,就可以将其评估为终点测定。以下检测是通过采用不同浓度的抑制剂(萝卜硫素)对MDA-MB-231细胞进行处理而进行的。
a.首先,计算每种条件的面积,这些值用于生成平均值和标准偏差:
b.接下来,将没有侵袭基质的球状体面积用作背景值,并从每个条件的平均值中减去:
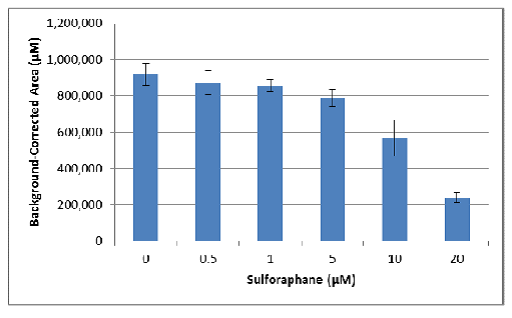
c.最后将产生的面积除以未作抑制剂对照处理获得的面积,以对照百分比的形式作为侵袭指数。
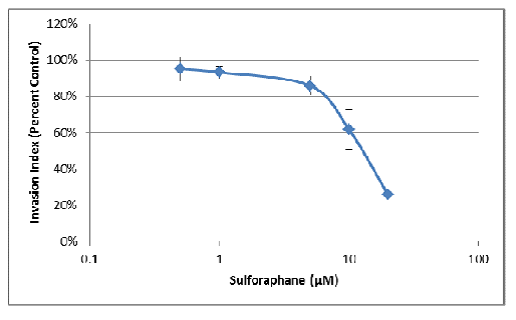
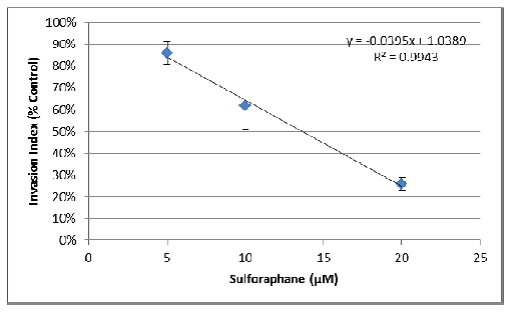
d.采用抑制剂曲线的线性部分进行IC50的计算(y=0.5时x的值)。
- 基于线性方程,x =(y - 1.0389)/ -0.0395。
- 因此IC50 =(0.5-1.0389)/ -0.0395 = 13.6μM 萝卜硫素
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?