超纯水在不含双酚A培养基中的应用
本研究旨在确定一种用于检测水中低浓度内分泌干扰物双酚A(BPA)的技术,更具体而言,说明如何利用配备Biopak®终端超滤器的Milli-Q® IQ 7000纯水系统(分子生物学应用的推荐配置)来生产参考超纯水以供对BPA敏感的胚胎学研究使用。
阅读更多
双酚A等内分泌干扰物的健康隐患
内分泌干扰物是指干扰人和动物内分泌系统的化工品。它们会影响生长以及生殖、免疫和神经系统,导致不利的健康后果。内分泌干扰物常见于塑料(包括实验室设备和耗材)、油漆、树脂和表面活性剂中,几乎无所不在。
有关规范和标准规定了食品饮料以及环境中允许内分泌干扰物存在的最大剂量。在工业生产的各种内分泌干扰物中,BPA是分布最广的内分泌干扰物之一。BPA以“仿雌激素”著称,因为它能模仿雌激素,从而造成严重的健康隐患。若干研究证实,BPA会干扰激素的产生及其基因表达。近期的研究表明,哪怕低水平的BPA(20µg/kg/day,相当于胎儿暴露一周的环境BPA剂量)也可能影响健康卵母细胞的产生(图1),干扰其在卵巢中的成长。1-3
以下研究旨在证实,由Milli-Q®纯水系统生产的超纯(1类)水适用于制备保证不含BPA的培养基和溶液,具体而言,为发育生物学实验提供无BPA培养环境。
- 研究1显示了使用高效固相微萃取技术结合气相色谱-质谱法(HP-SPME-GC-MS)对几种不同类型的水进行BPA分析的结果。
- 研究2展示了细胞学和分子分析的结果,以评估BPA对卵母细胞成熟过程的影响。
- 研究3说明了水对于细胞成像技术所使用的培养基的重要性。
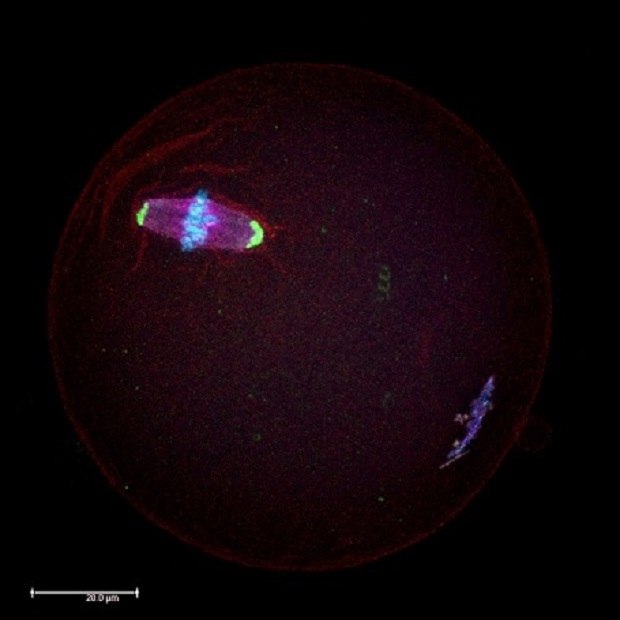
图 1.在小鼠卵母细胞的中期II(MII)减数分裂阶段,使用减数分裂纺锤体(红色)和中心体(绿色)中的蛋白质抗体所做的免疫细胞化学显微分析。染色体用DAPI(蓝色)复染。
研究1:利用HP-SPME-GC-MS技术测量胚胎学研究所用超纯水中的BPA含量
在生殖生物学研究中,水是用于执行分析的重要试剂(例如,培养基制备)。
意大利帕维亚大学的科学家们使用可再现的HP-SPME-GC-MS方法来分析其胚胎学研究所用超纯水中的BPA含量。所分析的超纯水由Milli-Q® IQ 7000超纯水系统制备,由Elix® 纯水系统结合先进反渗透(RO)、Elix® 去电离子(EDI)和紫外线杀菌灯等纯化技术来预处理纯水,类似于Milli-Q® HX纯水系统。Milli-Q® IQ 7000超纯水系统在取水点装有一个Biopak®终滤器(图2)。对于分子生物学应用,建议使用Biopak® 超滤精制器,以提供不含任何内毒素、核酸酶、蛋白酶和细菌的纯水。

图 2.使用HP-SPME-GC-MS方法对不同类型的实验室用水进行双酚A(BPA)实验分析的概略图。
HP-SPME-GC-MS分析表明,在4nM的检测限(LOD)内,实验室实验所用的Elix®纯水和Milli-Q®超纯水中均未检出BPA(表1)。
如前所述,实验用水取自Biopak®终滤器。图3显示了从配有Biopak®终滤器的Milli-Q® IQ 7000系统取水点连续3次获取的水样的典型分析结果。根据以下“材料和方法”一节所述的程序,对GC-MS分析的可重复性和稳定性以及BPA的日常波动进行了评估。
结果表明,取自Milli-Q® IQ 7000系统的超纯水水质未检出BPA (LOD = 4 nM)。具体而言,该分析表明BPA没有从系统溶解进产水,因为纯水系统的进水自来水中未检出BPA。
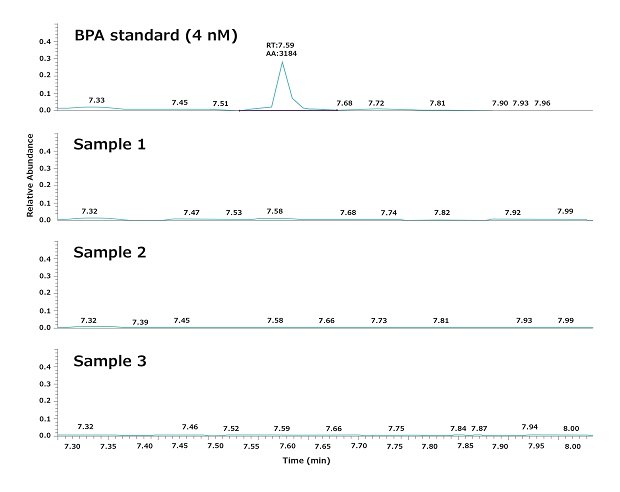
图 3.色谱图展示了3个超纯水样品中的BPA水平。水样连续取自配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统的取水点。
以下两项研究表明,可以放心使用Milli-Q®超纯水系统来提供无BPA污染的高质量水,尤其是经Biopak®终滤器纯化后的水,可进一步用于研究有关内分泌干扰物对发育中的配子和胚胎的影响。
研究2:将无BPA的超纯水用于细胞学和分子分析,以评估BPA对卵母细胞成熟过程的影响。
在测量某一特定分子的影响时,实验环境必须不含任何干扰分子。在该研究中, 科学家用 qRT-PCR 来分析4种母体效应基因的转录本表达: Brg1 (染色质重塑因子), Dnmt3a 和 Dnmt3l (DNA 甲基化酶)以及 Oct-4 (细胞多能性标志物)。样本包含3组单独的10个中期II(MII)小鼠卵母细胞,分别取自在10nM、100nM和1000nM BPA浓度下经过15小时体外成熟培养(IVM)的完全成熟的囊状卵母细胞。
结果表明,所测3个剂量的BPA未阻止卵母细胞的减数分裂成熟,绝大多数(96.5%)的卵母细胞达到了MII期,对照组(CTR)与暴露的样本之间没有明显区别。但是,在所有测试的BPA浓度下,所有受测基因的表达都发生明显改变(与未经处理的对照组相比,要么更高,要么更低),只有Oct-4在10nM浓度的BPA下未发生改变(图4)。
这些基因表达实验所使用的超纯水取自配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统。结果证明,取自Milli-Q®系统的超纯水适用于对BPA敏感的发育生物学应用。
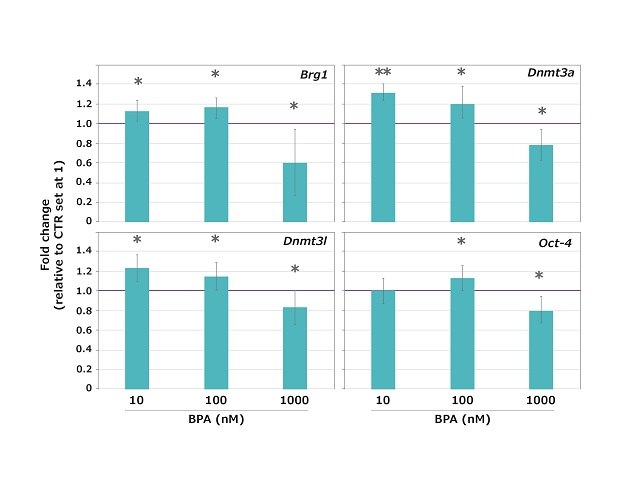
图 4.从GV转换到MII的过程中,小鼠卵母细胞中的Brg1、 Dnmt3a、 Dnmt3l和Oct-4母体效应基因暴露于10、 100 和 1,000 nM浓度的BPA时的表达图谱。对照组(CTR)样本的表达值设为1,以便计算倍数改变。数值计算方法:平均值±SD(标准差)。*p < 0.05;**p > 0.001。
研究3:将无BPA的超纯水用于细胞成像技术的培养基
利用延时成像技术可以观察卵母细胞从生发泡到MII期发育过程的内部活动(视频4)。这些被称之为“胞质运动速度(CMV)”的运动可作为一种无侵害的胞质标志来评估雌配子的发育能力(配子的质量和保持进一步发育的能力)。5,6 在本研究中,该新技术被用来探测卵母细胞在无BPA或者BPA浓度逐渐增加的条件下从GV到MII成熟转换过程中发生的CMV运动(图5仅显示了100nM BPA浓度的代表性数据)。
细胞粒子成像速度(Cell PIV)分析表明了卵母细胞对所测BPA剂量敏感的特定发育时间窗口。很明显,当暴露于10 nM的低BPA浓度水平时,CMV的改变分散在单个的时间点,而BPA剂量较高时,可以在GV到MII转换期间的较长时间内看到CMV的改变。具体而言,在染色质浓缩、着丝粒积聚成大的染色质核仁以形成MI板的时间间隔内,100 nM的BPA导致了明显的CMV差异(图5)。
以上CMV实验的培养基制备所使用的超纯水由配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统提供。研究结果突显了培养基不含BPA的重要性,因为无论是基因表达还是胞质运动的分析结果都表明,即使是100 nM的低剂量BPA也会产生影响。
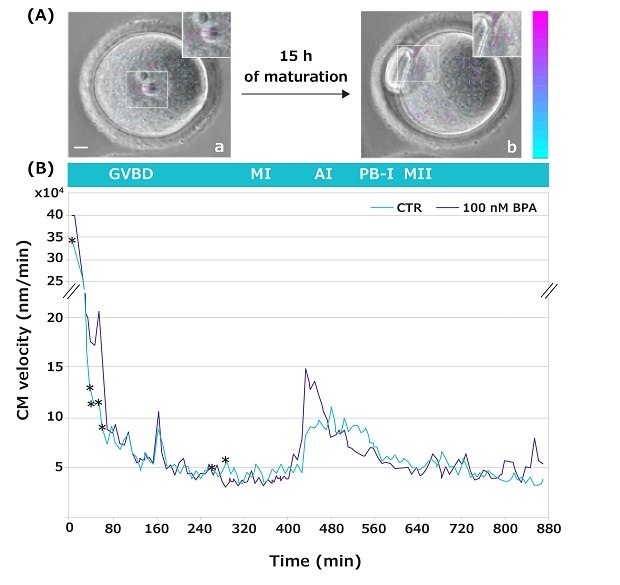
图 5.(A)代表性图像:第一帧为GV卵母细胞(a),第100帧为MII卵母细胞(b)。小图是带箭头(速度向量)的放大图像,显示了胞质运动的强度和方向。箭头的颜色和长度表示与上一帧相比的运动速度模块。彩色向量比例条(nm/分钟):蓝色表示低速度;紫色表示高速度。条:10μm。(B) 在GV到MII转换期间,卵母细胞在无BPA(绿色)和100 nM的BPA浓度下的胞质运动图谱。*p < 0.05。
结论:超纯水适用于胚胎发育研究中对BPA敏感的应用
科研技术的灵敏度和性能的日益提升要求使用高质量的纯水来防止出现影响实验结果的准确度和真实性的污染。特别是在采用突破性的检测技术进行研究时,科学家们要求使用高纯度的水来防止任何可能会干扰研究结果的挑战(例如,BPA、内毒素、核酸酶、蛋白酶和细菌),以便对实验结果有更大的信心。
在胚胎学领域,研究已经证明即便是低水平的内分泌干扰物BPA也能通过干扰卵母细胞的成长来影响胚胎发育的研究。这令人担忧,因为BPA尽管一开始不一定存在于实验室自来水进水中,也会从实验室耗材和设备中溶解出,导致对实验结果的干扰。
在本文中,尽管我们说明低水平的BPA不会阻止卵母细胞的减数分裂成熟,但即便是仅仅10 nM的极低BPA浓度也会影响基因表达以及从生发泡(GV)到MII期的发育转换过程中卵母细胞内部的运动。这些研究结果突显了在从事胚胎学研究时环境中不能含有BPA,包括使用确保没有检出BPA的超纯水。
根据本文所述方法,即便是在4 nM的极低检测限下,配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统所产的超纯水中也未检出BPA。因此,可以放心地使用本系统所产的超纯水来研究内分泌干扰物对配子和胚胎发育的影响。
如需寻找能适应BPA敏感分析需求的纯水解决方案, 请求实验室用水专家的支持。
BPA的HP-SPME-GC-MS分析所用材料和方法
仪器
- 使用一台Thermo Scientific DSQII单四极杆气相色谱质谱联用仪(TraceDSQII质谱仪,TraceGCUltra气相色谱仪)并配备一台CombiPAL自动进样器(CTC Analytics, Switzerland)来进行水样分析。
- 使用一个30mm长、0.25 I.D.、0.25 µm膜厚的Restek Rxi™ 5ms毛细管柱(5%二苯基95%二甲基聚硅烷 - 美国贝尔丰特Restek公司)以及氦气作为载气,持续流速为1.0 mL/分钟。
- 使用1个100 µm聚二甲基硅氧烷(PDMS)SPME纤维组件。每次分析开始前,该纤维采用针式加热器在250°C 温度下加热20分钟,以去除上次分析的残留物。
标准品制备
使用100%乙醇制备浓度为10 nM的BPA储备溶液。使用HPLC水进行一系列稀释,以获取1、2、4、40 nmol/L四种不同浓度水平下的校准曲线。
实验1:评估GC-MS分析的可重复性和稳定性
从三个水源分别连续采集3批水样(5 mL):自来水,Elix®纯水以及配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统的取水点。开始采样前,先取出5L水以冲洗系统。
实验2:评估BPA浓度的日常波动
在3天中每24小时一次从以下水源采集3批水样(5 mL):自来水,Elix®纯水以及配备了Biopak®终滤器的Milli-Q® IQ 7000超纯水系统的取水点。开始采样前,先取出5L水。如需要,可提供色谱图。
水样
将待分析的5 mL水样(指自来水、Elix®纯水和Biopak®过滤过的超纯水)加入容量为20 mL的玻璃瓶中。在每个瓶中,加入200 mg KHCO3、1 g NaCl和一次性磁性搅拌棒。
衍生化
在水样中加入30 µL乙酸酐,然后将瓶用一个带PTFE表面隔膜的顶空瓶铝盖进行密封。在80°C的温度条件下,完成为期5分钟的整个衍生化反应(以50rpm的速率连续搅动)。在80 °C温度条件下,使用100 µm PDMS纤维搅拌30分钟(500 rpm)来完成BPA的顶空萃取。SPME纤维在注射器中以250 °C温度保持2分钟完成脱附。
色谱分析
温箱的温度在150 °C保持2分钟,然后以每分钟30°C的频率增加到280°C并保持6分钟。注射进样以不分流的模式进行,不分流为时2分钟,PTV注射器的温度保持在250 °C。传输线的温度保持在290°C而离子源保持在250 °C。质谱以电子碰撞电离(EI)模式进行,以全扫描和SIM(选择监测)两种模式记录离子。在全扫描模式下,扫描质量范围为m/z 35-350amu,在SIM模式下,用质荷比270作为BPA的定量离子。
致谢
作者感谢意大利帕维亚大学发育生物学实验室实施了本研究,也感谢我们的研发同事对本项目所作的贡献。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?