O-连接糖蛋白回顾
O-连接糖蛋白通常是分子量>200kDa的大蛋白。糖基化通常发生在高密度簇上,并可占总量的50-80%。
结构
O-连接聚糖最常通过丝氨酸(Ser)或苏氨酸(Thr)残基与肽链连接。O-连接虽然主要通过羟基连接肽残基,但是不需要共有序列。酪氨酸(Tyr)、羟赖氨酸(Hydroxy-Lys)或羟脯氨酸(Hydroxy-Pro)也可作为O-连接糖基化的肽位点。
最常见的O-连接聚糖是黏蛋白型聚糖,它的起始残基是N-乙酰半乳糖胺(GalNAc)。黏蛋白型聚糖核心结构有八种(图1)。O-连接聚糖虽然具有常见黏蛋白型核心,但还是特别异质化,除了几种唾液酸化核心外,还有其他可能结构。不过O-连接聚糖通常是线性或双触角的,而且支链相对少于N-聚糖。
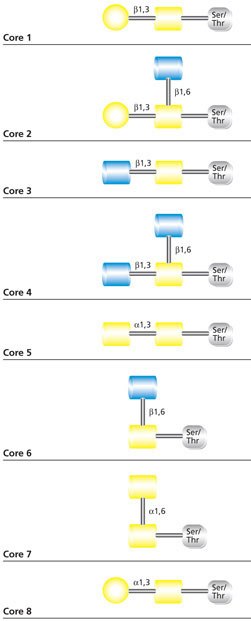
图 1.黏蛋白型O-聚糖的核心结构。
黏蛋白是一种含有大量高密度O-连接聚糖簇的糖蛋白。这些蛋白的黏蛋白型聚糖在水溶液中频繁交联形成高粘度凝胶(黏液)。黏蛋白可以分泌,也可以是膜结合型的,从而在细胞表面形成聚糖密集区。
除了黏蛋白型聚糖,O-连接聚糖可以整合GalNAc之外的糖作为起始糖与丝氨酸/苏氨酸残基结合。其他O-连接聚糖示例:
- 含GlcNAc作为起始糖的核、胞质糖蛋白。
- 含岩藻糖作为起始糖的纤溶和凝集因子。
- 酵母特征的甘露糖蛋白,整合了甘露糖作为起始糖。O-甘露聚糖也存在于人α-肌养蛋白聚糖和其他神经系统糖蛋白中。
- 组成蛋白聚糖的糖胺聚糖(GAG),含专一结合丝氨酸残基的木糖。
- 植物细胞壁伸展蛋白,既含有连接羟脯氨酸的阿拉伯糖,也含有连接丝氨酸的半乳糖。
- 植物阿拉伯半乳聚糖,通过O-连接半乳糖或葡萄糖连接肽链骨架内的羟脯氨酸。
- 半乳糖和α葡萄糖(1→2)半乳糖残基,结合胶原蛋白三螺旋结构内的羟赖氨酸。补体因子C1q也含有α葡萄糖(1→2)半乳糖-羟脯氨酸序列。
- 糖原蛋白是糖原合成所需蛋白前体,含与酪氨酸O-连接的葡萄糖;随后起始葡萄糖由糖原合成酶延伸生成糖原。
生物合成和降解
O-连接糖基化是确实发生在高尔基体的翻译后事件,并且不再需要寡糖前体用于蛋白传递。丝氨酸/苏氨酸残基被N-乙酰半乳糖胺残基的共价连接直接修饰。黏蛋白型O-糖基化的起始合成依赖多肽:N-乙酰氨基半乳糖转移酶(ppGalNAcT);至少鉴定出了12种哺乳动物的ppGalNAcT同工酶。黏蛋白型聚糖合成第一步需要以尿苷二磷酸-半乳糖酰胺(UDP-GalNAc)作为糖类供体并由ppGalNAcT催化。之后O-连接聚糖的延伸和终止由多种糖基转移酶开展。各种糖基转移酶的相对表达和亚细胞分布决定O-聚糖生物合成产量。O-连接聚糖的终止通常有半乳糖、N-乙酰葡糖胺、N-乙酰半乳糖胺、岩藻糖或唾液酸。半乳糖-β(1→3)-N-乙酰半乳糖胺核心目前最常见的修饰是单、二或三唾液酸糖苷化(Core 1和2)(图2)。不太常见但分布广泛的O-连接己糖结构含β(1→4)-连接半乳糖和β(1→6)-连接N-乙酰葡糖胺以及唾液酸。
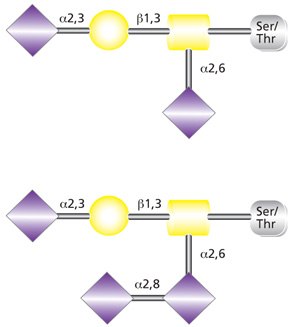
图 2.双唾液酸化(上)和三唾液酸化(下)O-连接核心1聚糖。
O-聚糖降解除了跟N-聚糖降解一样需要外切糖苷酶之外,还需要α-N-乙酰半乳糖胺酶。
功能
上皮细胞顶膜分泌的黏蛋白可以通过连接二硫键捕获水分子形成黏液膜。该膜物理性保护细胞免受胃酸和循环蛋白酶之类的恶意环境因素伤害。唾液分泌的黏蛋白为吞咽提供润滑。黏蛋白也能构建O-连接聚糖壁,通过吸引结合细菌碳水化合物结合受体来阻断病原体感染。许多细菌病原体表达黏附蛋白,一种特异作用细胞表面O-聚糖的碳水化合物识别蛋白,可作为受体结合并感染宿主细胞。黏附蛋白结合黏蛋白表面聚糖,阻碍了病原体的进一步侵袭;结合的病原体之后可被清除。
单个GlcNAc的糖基化是独特的O-糖基化形式,据示这种结构是动态的,不像其他O-连接糖基化是稳定的。这种修饰是可逆过程,并由尿苷二磷酸-N-乙酰葡糖胺:多肽β-N-乙酰葡糖胺转移酶(O-GlcNAc转移酶)和中性β-N-乙酰氨基葡萄糖苷酶(O-GlcNAc酶)催化。与GlcNAc O-连接的蛋白可在相同的肽位点磷酸化,而与磷酸化类似,O-GlcNAc修饰与细胞信号传递有关,包括胰岛素信号传递和RNA转录调节。1,2
更复杂的O-聚糖担当其他功能。透明带(ZP)糖蛋白是一种O-连接聚糖,以高浓度存在于围绕哺乳动物卵子的透明带中。人透明带基质含有4种ZP糖蛋白,而鼠透明带基质只有3种。3 ZP糖蛋白的作用还没完全确定但被认为同精子接收(sperm reception)有关。
O-连接聚糖也参与造血和炎症反应机制。P-选择素糖蛋白配体1(PSGL-1)及其他聚糖含有唾液酸化LewisX抗原修饰的Core 2 O-聚糖(C2O-sLeX,图3)。PSGL-1是P-选择素的主要黏附目标,也是E-选择素的目标,参与白细胞滚动和炎症位点招募。4
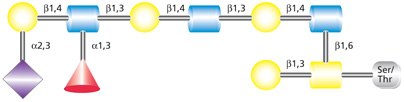
图 3.结合唾液酸化Lewis X (sLex)的O-连接Core 2聚糖结构。
人ABO血抗原是小的O-连接聚糖,可连接膜糖蛋白或细胞表面糖脂。抗原也可作为游离寡糖或可溶性糖蛋白和鞘糖脂由组织分泌。O(H)血型决定子不会引起免疫反应,但修饰添加α(1→3)GalNAc(A型抗原)或 α(1→3)半乳糖(B型抗原)后,所得三糖会引发免疫反应(图4)。

图 4.(A)H(O)型、(B)A型和(C)B型抗原的结构。R代表含羟基氨基酸或抗原脂质结合位点。
T抗原和Tn抗原是糖基化不完全的O-聚糖。T抗原(肿瘤相关或TF(Thomsen-Fridenreich)抗原)是病毒或细菌神经氨酸酶去唾液酸化得到的Core 1 二糖(半乳糖-β(1→3)GalNAc)。可用糖基转移酶变化也会产生T抗原。Tn抗原是一种O-连接GalNAc,没有经糖基转移酶延伸成为完整的核心结构。这些抗原不在正常细胞表面表达,通常存在于癌变细胞并可作为肿瘤标志物。
Schindler病已被鉴定为一种影响O-连接聚糖的先天性糖基化障碍症,由α-N-乙酰半乳糖胺酶缺乏引起。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?