如何优化 Duolink® 邻位连接实验
要成功地执行 Duolink® PLA 实验,实验方案中有一些必要的考虑因素需要正确地准备、设置和执行。Duolink® PLA 产品可用于荧光和明场。荧光 Duolink® PLA 试剂可用于显微镜和流式细胞术应用。
实验设计
要设计一个成功的Duolink® PLA实验,必须考虑很多因素。这些因素包括但不限于:
- 确定蛋白质靶标和实验类型
- 选择样品(细胞或组织)
- 设计您的读出方案
- 设计实验对照(技术和生物)
靶标识别
首先要确定的是目标蛋白靶标。是单一蛋白质表达,蛋白质与蛋白质的相互作用 (PPI),还是蛋白质翻译后修饰 (PTM)?下面简要介绍了 Duolink® PLA 如何用于检测各种类型的蛋白靶点。
单一蛋白表达的检测
检测单个蛋白靶标有两种方法,即使用针对靶标的一种一抗进行单一识别或两种一抗进行双重识别。
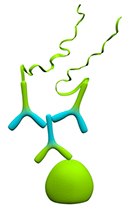
图 1.单一识别
单一识别具有最高的灵敏度,建议在检测低表达水平的单一蛋白质靶标时使用。也可用于双重识别实验前对单个一抗浓度的测定。但是,只有当性能良好的特异性一抗可用时,才推荐使用此方法。由于测定的敏感性,使用非特异性一抗将导致高背景。
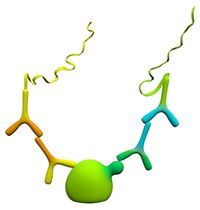
图 2.双重识别
双重识别通过使用两种一抗提供了更高的特异性。每种一抗必须针对同一靶分子上不同的、非竞争性的表位。而且,这两种一抗必须在不同物种(小鼠、兔或山羊)中培养,并且必须在相同的实验条件下与靶标结合。这些条件在下面的实验准备部分中进行了描述。
蛋白质与蛋白质的相互作用检测
Duolink® PLA是检测蛋白质相互作用的绝佳方法。该方法使用两种一抗来完成,每种抗体针对一种目标靶标,且在不同物种(小鼠、兔或山羊)中培养。两种一抗必须在相同的实验条件下与靶标结合。
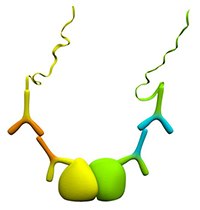
图 3.蛋白质相互作用
蛋白质与核酸的相互作用检测
蛋白质-DNA 和蛋白质-RNA 相互作用也可以通过使用修饰的原位杂交技术结合Duolink® PLA来进行检测。有关使用 Duolink® PLA 检测蛋白质-DNA 或蛋白质-RNA 相互作用的详细信息,请参阅参考文献。
样品选择
对样品和蛋白质靶标的已有了解十分重要。选择具有已知靶蛋白表达的系统将显著增加Duolink® PLA实验成功的几率。
Duolink® PLA实验所需的样本与用于传统免疫荧光 (IF)、免疫组织化学 (IHC) 或流式细胞术的样本相同。因此,Duolink® PLA试剂适用多种样品类型,包括:
- 贴壁细胞
- 悬浮细胞
- 血细胞
- 细胞离心涂片制剂
- 石蜡包埋细胞样品
- 石蜡包埋组织切片
- 冰冻组织切片
- 新鲜组织切片
在进行 Duolink® PLA 实验之前,必须对所有样品进行固定。对于流式细胞术应用,需要使用悬浮细胞。
选择读出方法
Duolink® PLA产品提供了荧光和明场版本选择。荧光 Duolink® PLA 试剂可用于显微镜和流式细胞术应用。
选择读出方法的关键考虑因素是专用设备的可用性。荧光显微镜是 Duolink® PLA 实验最常用的读出设备。上述所有样品类型均可与荧光Duolink® PLA 试剂一起使用,不过,部分样品会表现出明显的自发荧光。如果发生这种情况或当荧光仪器不可用时,可用光学显微镜进行明场Duolink® PLA实验。
流式细胞术方案对于仪器类型是不可知的(假设实验设计所需的合适滤光片可用),并且较易于适用于贴壁或悬浮细胞。
实验对照
Duolink® PLA 结果为蛋白质事件(表达、相互作用或修饰)提供了相对定量。因此,加入技术对照组,以及在可能的情况下加入生物对照组,是十分重要的。
技术对照
每个 Duolink® PLA 实验中应该包含两个技术对照组。这包括:
- 分别省略一种一抗
- 用于检测每种一抗的非特异性结合
- 有助于确定最佳一抗效价
- 省略所有一抗
- 用于检测系统中 Duolink® PLA 探针的非特异性结合
生物对照
除了技术对照外,强烈建议使用生物对照。阳性和阴性生物对照均可提供有价值的信息。
- 阳性对照
- 用含已知蛋白表达、相互作用或修饰的单独样本来测试试剂
- 可诱导系统(如生长因子刺激、热休克等)的使用将提供Duolink® PLA信号的生物学相关性
- 阴性对照
- 使用不表达蛋白质靶标的样品(例如敲除、沉默等)将提供一抗特异性的信息
- 使用不相关抗体(例如同种型 IgG、非相互作用蛋白的抗体等)将提供关于Duolink® PLA 探针特异性的信息
- 使用阻止蛋白质相互作用或修饰的抑制剂将提供 Duolink® PLA 信号的生物学相关性
实验准备
为确保成功执行 Duolink® PLA 实验,需要进行大量准备工作。这些准备工作与传统的 IF、IHC 或流式细胞术所需的工作类似。本节描述了一抗鉴定、样品制备和抗体优化的注意事项。
一抗的选择
Duolink® PLA试剂是使用二抗进行靶标特异性一抗检测的通用试剂。设置 Duolink® PLA 实验时,一抗的选择至关重要。
要求
Duolink® PLA探针是驴抗小鼠、抗兔或抗山羊二抗;因此,对一抗有特定要求。这包括:
- 宿主必须是小鼠、兔子或山羊(特例情况要求使用Duolink® Probemaker)
- IgG 类
- 可以是单克隆或多克隆
- 优选亲和纯化以使交叉反应性最小化
- 建议使用 IF 或 IHC 验证
直接偶联一抗的使用
有些情况下需要使用直接偶联的一抗。Duolink® Probemaker能够将 PLA oligo (PLUS 或 MINUS) 偶联到任何抗体上。使用 Duolink® Probemaker 的注意事项如下:
- 当一抗的宿主不是小鼠、兔或山羊时
- 当使用来自同一物种的两种一抗时
- 当使用在与组织样品相同的宿主中产生的一抗时(例如,“小鼠一抗检测小鼠样品”)
一抗优化
为了成功执行 Duolink® PLA 实验,确定待测样品中最佳一抗性能的条件非常重要。一抗优化的条件应包括:
- 样品处理(固定、透化和抗原修复)
- 一抗浓度
- 阻断溶液和抗体稀释剂
下面介绍样品处理、阻断和抗体稀释剂的具体注意事项。强烈建议首先通过 IF 或 IHC 染色鉴定一抗的条件。当使用两种一抗时,每种一抗的优化应分开进行,但样品处理需要兼容两种一抗的最佳性能。
一旦 通过IF 或 IHC 确定了条件,这些条件就可以应用于 Duolink® PLA。但是,Duolink® PLA 实验可能需要进一步滴定一抗浓度,因为与 IF 和 IHC 相比,Duolink® PLA 具有更高的灵敏度和更放大的信号。使用上述Duolink® PLA单一识别方法可在优化一抗浓度时提供最高的灵敏度。这些条件可用于使用两种一抗的 Duolink® PLA 实验。
样品处理
样品应在固定、透化和抗原修复方面进行适当的处理。实验中所用一抗的条件优化对检测性能至关重要。
固定
固定过程用于固定抗原,同时保留细胞和亚细胞结构。固定剂的选择可根据样品类型(细胞或组织)、一抗和蛋白靶标的不同而不同。不同的固定剂可影响一抗的抗原性,从而影响一抗的性能。如果所选一抗没有推荐固定方法,则必须由用户进行优化。
Duolink® PLA试剂与 IF 和 IHC 的所有常用固定剂兼容,包括:
- 丙酮
- 乙醇
- 甲醛
- 甲醇
- 多聚甲醛
- 锌
透化
抗体进入细胞内表位需要透化作用。这通常是通过 Triton X-100、NP-40、Tween-20 或 digitonin等去垢剂来实现。有许多去垢剂可供选择——使用一种最适合固定和所用样品的去垢剂。值得注意的是,一些固定剂(如丙酮和甲醇)也会引起透化,因此可能不需要额外的透化步骤。
抗原修复
抗原修复用于显示在固定过程中被掩盖的抗原表位,从而允许抗体结合。抗原修复最常用于福尔马林固定的石蜡包埋 (FFPE) 样品,但有时也用于悬浮固定的细胞。不同的抗原修复方法可能影响一抗的性能,因此必须由用户进行优化。
两种主要方法是热诱导抗原修复法 (HIER) 和酶诱导抗原修复法 (PIER)。Duolink® PLA 与 IHC 的常用抗原修复缓冲液兼容,包括:
- HIER:Trilogy™、柠檬酸盐、EDTA 和高 pH Tris
- PIER:用蛋白酶 K、胃蛋白酶和胰蛋白酶处理
封闭液和抗体稀释剂
Duolink®封闭液和抗体稀释剂含有 Duolink® PLA 探针(PLUS和MINUS)。这些溶液已进行优化,可与Duolink® PLA试剂配合使用,以最大限度地减少抗体和检测寡核苷酸的非特异性结合。然而,在这些条件下,必须验证您的一抗与目标蛋白靶标的特异性结合。应通过 Duolink® PLA 单一识别实验,或者 IF 或 IHC 来分别检测每种一抗。
如果您之前已经确定了用于IF 或 IHC 染色的封闭液和/或抗体稀释剂,则这些溶液很可能也可用于 Duolink® PLA。在这些溶液中不应该使用来自与您的一抗相同物种的同种型 IgG 作为封闭液,因为这将导致来自 Duolink® PLA 探针的错误信号。
附录
反应体积
为获得理想的结果,应根据反应面积调整反应体积。1 cm2面积对应于40μl 反应体积。请根据您的反应面积调整反应体积。总反应体积切勿小于 15μl。
小面积对应体积选择指南
0.2 cm2 – 15 μL 总反应体积
1 cm2 – 40 μL 总反应体积
2 cm2 – 80 μL总反应体积
3 cm2 – 120 μL总反应体积

图 4.
大面积对应体积选择指南
1 cm2 – 40 μL总反应体积
4 cm2 – 160 μL总反应体积
6 cm2 – 240 μL总反应体积
8 cm2 – 320 μL总反应体积
10 cm2 – 400 μL总反应体积

图 5.
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?