利用in situ PLA检测蛋白质间的互作

利用in situ PLA技术联合Prestige单抗和多抗检测蛋白质互作
蛋白质是维持细胞结构和功能所必需的复杂生物分子。大多数蛋白质通常与各种分子(包括其他蛋白质)互作而发挥功能。这些蛋白质互作涉及广泛的细胞过程,如蛋白质修饰、转运、信号传导和细胞周期。
蛋白质互作研究对于表征正常和疾病状态下蛋白质的细胞生物学功能至关重要。有许多技术可用于评价蛋白质互作,如免疫共沉淀、pulldown检测、交联和far-Western blot分析。尽管这些技术为研究蛋白质互作提供了强大的工具,但它们缺乏显微镜分析天然组织或细胞时具备的亚细胞分辨率。
邻位连接技术(PLA)(Duolink®)可对组织或细胞中的蛋白质互作进行原位分析(即is PLA)。1该方法可用于检测、成像和定量蛋白质互作,以及检测细胞或组织切片中的个体蛋白质和蛋白质修饰。
为获得可靠的PLA检测结果,一抗的选择至关重要。只有具备高特异性和选择性的抗体才能实现成功的PLA反应。一般要求一抗是IgG类且经过亲和纯化,尤其重要的是具有靶点特异性。此外,为了检测两种蛋白质之间的互作,两种一抗必须来自两种不同物种,比如兔和小鼠。
由于上述原因,Atlas Antibodies提供了大量可用于PLA检测的一抗。产品目录中有超过18000种多克隆抗体(Prestige Polyclonals)和270种单克隆抗体(Prestige Monoclonals)可供选择,它们靶向75%以上的人类蛋白质编码基因。Prestige Polyclonals和Prestige Monoclonals均采用精心设计的抗原开发而成。独特的抗体纯化工艺采用重组抗原作为Prestige Polyclonals的亲和配体,使这些抗体具有较高水平的特异性、重现性和通用性。Prestige Monoclonals采用蛋白质A色谱柱进行纯化。重要的是,通过对44种正常和20种癌症组织进行广泛的IHC分析,使抗体特异性得到了验证。
如上所述,与其他技术相比,PLA的主要优势是能够利用显微镜在观察天然组织切片或细胞方面所具备的亚细胞分辨率来检测蛋白质互作。这对于癌症研究等尤其重要,包括疾病诊断、患者分层和生物标志物研究。2
为最佳保存样本和目标抗原的形态,有必要认真考虑样本固定方法。福尔马林固定的石蜡包埋组织(FFPE)切片通常可提供最佳的组织形态保存。值得注意的是,Atlas Antibodies产品目录中的所有抗体都经过验证并被批准用于经过加热抗原决定簇修复的人类(在一些情况下可用于啮齿动物)FFPE样品。
In situ PLA原理
Is PLA3技术基于寡核苷酸标记抗体(PLA探针)的使用,其仅在两个探针非常接近(约30nm)时才产生信号。随后,所产生的DNA环中的一个DNA探针成为滚环扩增(RCA)的引物(图1 A,B)。通过加入DNA聚合酶,形成一个依然附着于PLA探针的长DNA产物(图1 C)。RCA结束后,相同序列的串联重复序列能够与多个检测寡核苷酸杂交(图1 D)。每个被检测到的PLA探针对的信号就是一个独立的荧光点,可利用显微镜进行观察并定量。利用成像分析软件,如BlobFinder,可将PLA信号(点)定位到特定的亚细胞位置并进行定量。4
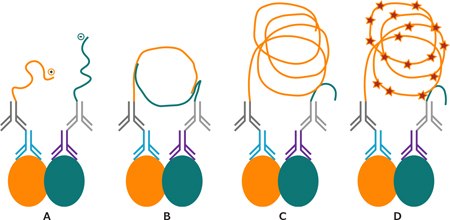
图 1.PLA反应示意图。与一抗孵育后,与PLA PLUS和MINUS探针一起孵育(A)。与寡核苷酸连接子杂交并使用连接酶催化DNA环形成(B)。滚环扩增(C)。与荧光标记寡核苷酸杂交,用于信号检测(D)。
is PLA – 方案简述
1.组织预处理,以获得最佳抗体性能(如HIER,pH=6)
2。封闭
3。一抗孵育
4.洗涤
5.PLA®探针孵育,在37 °C孵育60分钟。
6.洗涤
7.连接孵育,在37 °C孵育30分钟。
8。扩增孵育,在37 °C孵育100分钟。
9.洗涤
10.准备成像
使用含DAPI的Duolink In Situ封片剂封固样品。
以下是利用is PLA以及Prestige单抗和多抗检测FFPE人类组织切片中的蛋白质互作的三个实例。
核膜中的Emerin-lamins互作
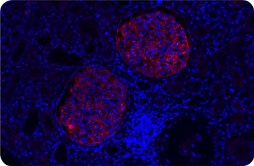
核膜隔离了细胞核和细胞质,保护细胞核的结构完整性并控制细胞核与细胞质之间的分子通道。5Emerin(EMD)是一种内层核膜蛋白,与细胞核的机械完整性和组织特异性基因调控均有关。6核纤层蛋白(Lamin)是内层核膜下方核纤层的主要成分。它们作为内层核膜与染色质之间的桥梁7,为核膜提供机械支撑、维持合适的染色质组织结构和转录调控。8Emerin与Lamin的互作对于维持细胞和完整性具有重要作用。9Emerin和Lamin基因突变导致的病理现象被称为“核膜病症”。10
在此,我们分别使用了抗EMD小鼠单克隆抗体AMAb90560(1:5000,图2 A)和抗LMNA兔多克隆抗体(HPA006660,1:30,未展示)或LMNB1兔多克隆抗体(HPA050524,1:150 图2 B),对复层扁平上皮细胞核膜中的EMD-LMNA(图2 C和EMD-LMNB1(图2 D)互作进行了可视化。位于核膜区域的红色免疫荧光PLA信号(图2 C,D)与IHC染色(图2 A,B)相对应。使用DAPI复染细胞核(图2 C,D)。
上皮细胞膜中的E-cadherin – β-catenin互作
上皮细胞作为渗透屏障,可将其下方细胞与环境隔离。该功能需要细胞之间相互紧密连接。E-钙黏蛋白(E-cadherin,CDH1)是一种能够与β-连环蛋白(β-catenin,CTNNB1) 形成复合物的跨膜蛋白,它对于上皮细胞之间的粘附作用至关重要。钙黏蛋白介导的细胞接触中缺失连环蛋白,是上皮间充质转化(EMT)过程的一个重要因素。11,12 EMT过程被认为是肿瘤细胞转移扩散过程中的一个重要事件。在该过程中,上皮肿瘤细胞获得了更具活力和侵袭性的表型,并从原发性肿瘤中扩散出来。13
在此,我们使用抗CDH1单克隆抗体AMAb90865(1:1000)和抗CTNNB1多克隆抗体HPA029159(1:600)检测正常上皮组织膜中的CDH1- CTNNB1互作,包括前列腺(图3 A)、输卵管(图3 B和结肠(图3 C)。注意上皮细胞(图3 A-C)中的强膜阳性以及扁桃体淋巴组织(阴性对照,图3 D)中的PLA信号缺失。使用DAPI复染细胞核。
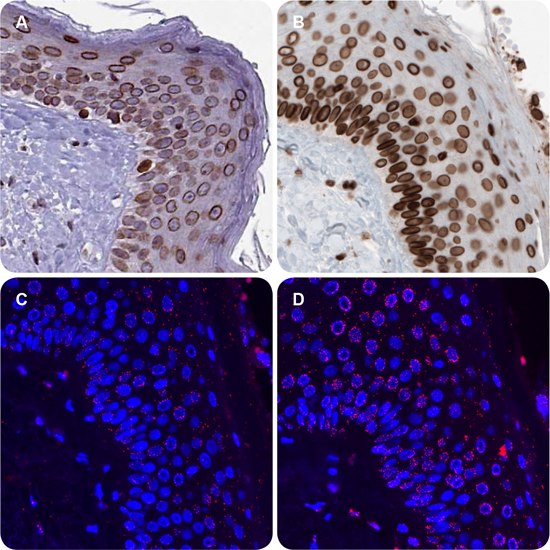
图 2.使用EMD抗体AMAb90560 (A) 和LMNB1抗体HPA050524 (B)进行IHC染色,结果显示皮肤上皮细胞具有明显的核膜免疫反应。免疫荧光is PLA信号分别显示了皮肤上皮细胞核膜中EMD och LMNA (C)以及EMD och LMNB1 (D)的蛋白质互作。

图 3.免疫荧光is PLA信号显示了前列腺(A)、输卵管(B)和直肠(C)上皮细胞膜中CDH1与CTNNB1的蛋白质互作。扁桃体为阴性对照(D)。
肾小球膜中的足萼样蛋白-埃兹蛋白互作
细胞膜含有多种蛋白质,它们参与维持细胞结构、跨膜运输和信号转导等过程。足萼样蛋白(Podocalyxin-like protein,PODXL)是一种具有抗粘附性质的跨膜唾液粘蛋白。在正常肾脏中,PODXL的功能是维持足状突细胞中相邻足突之间的过滤通道处于开放状态。PODXL也被证明与癌症的发展和侵袭性有关14-17,至少部分原因是它与肌动蛋白结合蛋白埃兹蛋白(ezrin,EZR)之间的互作。18,19
PODXL和EZR均在正常肾小球膜和输卵管纤毛上皮中表达。在此,我们利用is PLA技术以及PODXL单克隆抗体AMAb90644(1:5000)和EZR多克隆抗体HPA021616(1:2500)证明这些蛋白之间的互作。注意肾小球膜(图图4A,B)和输卵管上皮细胞顶膜(图4 C)中的强PLA信号。肝脏被作为阴性对照(图4 D)。使用DAPI复染细胞核。

图 4.免疫荧光PLA信号显示了肾小球(图A和B)以及输卵管纤毛上皮(图C)中PODXL和EZR之间的蛋白质互作。肾小管(图A和B)以及输卵管的下层结缔组织(图C)无信号。肝脏为阴性对照(图D)。
总结
本文提供的数据证明了如何利用强大的PLA技术联合Prestige单抗和多抗对人类组织中的蛋白质互作进行原位检测。基于这些数据的研究可以进一步帮助我们了解正常和病理状态下的蛋白质功能。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?