Northern & Southern Blot Protocols
Southern Blotting Protocol
Northern Blotting Protocol
What are Northern & Southern Blotting?
The transfer of macromolecules such as nucleic acids and proteins to solid-phase membranous support is known as blotting. Fragments of DNA and RNA molecules separated by gel electrophoresis are transferred to a nylon or nitrocellulose membrane in a process termed as Southern and Northern blotting, respectively. Southern blotting was introduced by Edwin Southern in 1975 as a method to detect specific sequences of DNA in DNA samples. The other blotting techniques emerged from this method have been termed as Northern (for RNA), Western (for proteins), Eastern (for post-translational protein modifications) and Southwestern (for DNA-protein interactions) blotting.
Southern and Northern blotting protocols involve the following major steps:
- Purification of DNA/RNA: Extract and purify the DNA/RNA from either cells or tissue sources.
- Digestion of DNA: Digest the DNA into fragments with restriction enzymes. This step is not required for RNA.
- Gel electrophoresis: Separate the DNA fragments on agarose gel. The RNA samples can be separated on agarose gel with formaldehyde as the denaturing agent that limits secondary structures of RNA molecules.
- Transfer: Transfer the DNA/RNA fragments from the gel onto a nylon membrane.
- Prehybridization (Blocking): Wash the nylon membrane with a prehybridization solution containing salmon sperm DNA to block non-specific DNA interactions and reduce background noise. Alternatively, use the PerfectHyb™ Plus buffer, which doesn't require salmon sperm DNA for blocking.
- Preparation of probe: Prepare fresh probe DNA and label with 32P alpha-labeled dCTP.
- Hybridization: Incubate the blot with labeled probe.
- Detection of probe: Detect the probe and the DNA/RNA sequence of interest by exposure to film at -80 °C.
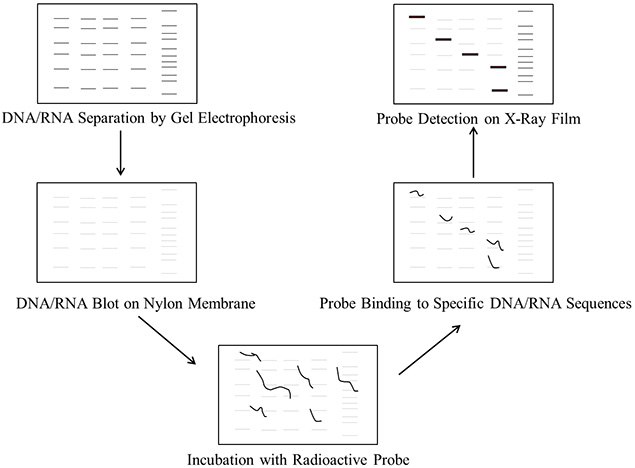
Figure 1.Steps involved in DNA/RNA blotting procedure
Southern Blotting Protocol
Materials Required
- Reagents for DNA isolation and purification
- Reagents for restriction digestion of DNA
- Reagents and buffers for agarose gel electrophoresis
- Apparatus for agarose gel electrophoresis
- Whatman filter papers
- Paper towels
- Positively charged nylon membrane
- Salmon sperm DNA
- Hybridization tube
- X-Ray films
Buffers Required
- 10X TBE (93290), used during gel electrophoresis. TAE buffer (65497) may be used in place of TBE for larger DNA fragments. Alternatively, use Bionic™ Buffer (B6185) in place of TAE or TBE for sharper bands in less time. You may prepare the 10X TBE buffer with the following reagents:
TRIS 1.3 M
Boric acid 450 mM
EDTA 25 mM
- 20X SSPE (S2015), used as a prehybridization and transfer buffer. 20X SSC (93017) may be used in place of SSPE in similar blotting protocols. Alternatively, you may prepare the 20X SSPE solution with the following reagents:
NaCl 2.98 M
EDTA 0.02 M
Phosphate buffer (pH 7.4) 0.2M
- Denaturing solution (N1531), used to denature dsDNA, making it accessible to the probe. Alternatively, you may prepare the 1X denaturing solution with the following reagents:
NaCl 1.5 M
NaOH (S5881) 0.5 N
Adjust the pH to ~13
- Neutralizing solution (N6019), used to neutralize the gel after denaturing dsDNA. Alternatively, you may prepare the 1X neutralizing solution with the following reagents:
NaCl 1.5 M
TRIS HCl 1 M
Adjust the pH to 7.5
- *Denhardt’s solution (D2532), used during prehybridization to block non-specific DNA hybridizations. Alternatively, you may prepare the 50X Denhardt’s solution with the following reagents:
Bovine serum albumin (A7906) 1%
Ficoll (F2637) 1%
Polyvinylpyrrolidone (PVP40) 1%
Dissolve the components in water to a final volume of 50 mL. Sterilize by filtration. - *2X Prehybridization solution (P1415), used to prepare the membrane for probe hybridization. Alternatively, you may prepare the 1X prehybridization solution (100 mL) with the following reagents:
20X SSPE 30 mL
100X Denhardt’s solution 10 mL
10% SDS 10 mL
Water 50 mL
- *Hybridization solution (H7140), used during the hybridization step. Alternatively, you may prepare the hybridization solution (100 mL) with the following reagents:
20X SSPE 30 mL
10% SDS 10 mL
Water 60 mL
- 1X Probe buffer, used for the probe mix. (100 µL; make fresh):
1 M TRIS, pH 7.6 50 µL
2 M MgCl2 5 µL
0.5 M DTT 10 µL
Water 35 µL
- 1X Probe mix (27 µL):
Probe buffer 2.7 µL
Oligonucleotide probe (0.2 µg/µL) 2 µL
T4 phosphonucleotide kinase (PNK) 1 µL
Water 11.3 µL
32P-ATP 10 µL
- 6X Low-stringency wash solution, used to remove low-homology hybridizations and reduce background noise. Prepare 600 mL of wash solution using the following reagents:
20X SSPE 180 mL
10% SDS 12 mL
Water 408 mL
- 1X High-stringency wash solution, used to remove closely homologous hybridizations and further reduce background noise. Prepare 600 mL of wash solution using the following reagents:
20X SSPE 30 mL
10% SDS 12 mL
Water 558 mL
*PerfectHyb™ Plus Hybridization Buffer (H7033) can be used in place of Denhardt, prehybridization, and hybridization solutions. PerfectHyb™ Buffer has been optimized to yield maximum signal with minimum background in hybridizations as short as 1-2 hours. PerfectHyb™ Plus has been formulated to work in any hybridization protocol, utilizing any type of probe, and on any type of membrane (positively charged or neutral nylon and nitrocellulose).
Isolation of DNA
Sigma-Aldrich offers GenElute™ kits for isolation of DNA from plants and fungi (E5038), mammalian cells or tissue (G1N70, G1N10 and G1N350) and blood (NA2010 and NA2020). The detailed protocol of DNA isolation by using GenElute™ kits may be found here.
Additionally, DNAstable® kits (93000-001-1EA, 93021-001-1EA, 53091-016-2ML and 93121-017-1EA) may be used in case the DNA is being shipped or for storage and stabilization of DNA at room temperature.
Restriction Digestion
Digest the DNA sample with appropriate restriction enzyme for 2-24 h at 37 °C. If the DNA sample is clonally derived a digestion time of 1-2 h is sufficient. For genomic DNA, overnight incubation is generally required with excess enzyme (5-10X).
If necessary, concentrate the digested DNA using ethanol precipitation. The traces of ethanol must be completely removed before separation on the gel.
Gel Electrophoresis
Resolve the digested DNA on agarose gel. TAE should be used for shorter runs (<4hrs) and larger DNA fragments, while TBE should be used for longer runs (>4hrs) and smaller DNA fragments (<1kb). Alternatively, use Bionic™ Buffer (B6185) for sharper band resolution in less time than TAE or TBE (for more information see Bionic™ Buffer Data). Stain the gel with ethidium bromide and acquire the gel image using UV transilluminator. If ethidium bromide has been incorporated into the agarose prior to electrophoresis, the gel image can be acquired immediately after the run.
Transfer
During the transfer step the DNA (or RNA) from the electrophoresis gel will be transferred onto a nylon membrane so it may be accessible to a probe for hybridization and detection.
- Transfer the gel into a tray containing denaturing solution enough to cover the gel completely. Wash the gel twice with this solution, each wash lasting for 25 min on a shaker.
- Rinse the gel with water twice.
- Wash the gel twice with neutralizing solution, each wash lasting for 15 min on a shaker.
- Rinse the gel with water twice.
- Wash the gel with 20X SSPE on a shaker for 30 min.
- During the above step, prepare the Whatman paper and membrane for the transfer procedure.
- Cut a strip of the nylon membrane (15356) and soak it in water. Cut a strip of Whatman paper, wider than the gel and soak it in 10X SSPE buffer (transfer buffer).
- Cut three strips of Whatman paper almost the same size of the gel.
- Cut multiple paper towels almost the same size of the gel.
- Place a stable platform on a tray containing 10X SSPE.
- Place a saran wrap on the platform. Place a Whatman paper soaked with 10X SSPE on the saran wrap. Ensure no air bubbles are trapped by rolling them off using a glass rod. Ensure that the edges of the Whatman paper are touching the SSPE buffer in the tray. This piece of Whatman paper will act as a wick to pull the SSPE buffer up and through the gel, depositing the DNA bands onto the nylon membrane.
- Place the gel, face down on the wet Whatman paper. Place the membrane on the top of the gel. Ensure no air bubbles are trapped by rolling them off using a glass rod.
- Place three strips of Whatman paper on the membrane. Ensure no air bubbles are trapped by rolling them off using a glass rod.
- Place a stack of paper towels on this, followed by weight (such as glass slab).
- Let this assembly stand overnight for complete transfer of the DNA fragments. Transfer of DNA fragments up to 15kb takes about 18 hours.
- After the transfer is complete, place the blot in a UV crosslinker on automatic setting. UV crosslinking is done to covalently bind DNA or RNA to a nylon membrane, which increases hybridization signals during detection. Another option is to bake the dry membrane after the transfer, which results in non-covalent but semi-permanent bonds of nucleic acids to the membrane. DNA cannot be UV crosslinked to a nitrocellulose membrane and must be baked.
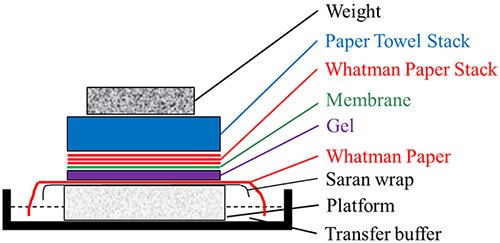
Figure 2.Southern/northern blot transfer assembly
Prehybridization (Blocking)
The prehybridization step (also known as blocking) is done to minimize non-specific attachments of a probe to the nylon membrane. Salmon sperm DNA is commonly used as a blocking agent to prevent the probe from sticking to the membrane, ensuring that it will only interact with the desired DNA bands that have been transferred to the membrane. Prepare the prehybridization solution as follows or use PerfectHyb™ Plus buffer (H7033):
- Warm the prehybridization solution to 42 °C.
- Heat a sample of salmon sperm DNA (D9156) to 95 °C for 5 min and immediately chill on ice.
- Add salmon sperm DNA to the warm prehybridization solution so that the final concentration of DNA is 50 µg/mL.
- Take the blot out of UV crosslinker and roll it carefully into a hybridization tube.
- Add prehybridization solution with sperm DNA into the hybridization tube and place it at 42 °C in hybridization oven for 5 h.
Hybridization
A complementary strand of DNA (a probe) is used to detect the desired sequence that should be present on the membrane. DNA from two different sources combine to make a "hybrid" dsDNA, but only if the two strands are homologous.
- Prepare 1X probe mix and incubate in water bath at 37 °C for 40 min.
- The free label (unincorporated probe) can be removed by passing the probe mix through G-25 Sephadex column.
- Determine the specific activity of the probe using liquid scintillation.
- Warm 10 mL of hybridization solution to 49 °C, add 10-15 X 106 cpm of probe to it and mix well.
- Discard the pre-hybridization solution from the blot; add the hybridization solution with the labeled probe. Incubate overnight at 49 °C.
Note: Alternatively, use PerfectHyb™ Plus buffer (H7033) to hybridize for a much shorter amount of time with stronger signal yield. For more protocol information and data see PerfectHyb™ Plus Protocol.
- Warm the 6X wash solution to 49 °C. Discard the hybridization solution from the blot and add 6X wash solution.
- Warm the 6X low-stringency wash solution to 49oC. Discard the hybridization solution from the blot and add the 6X wash solution. The low-stringent wash removes low-homology hybridizations in order to leave high-homology interactions behind, refining the desired DNA sample.
- Prepare the 1X high-stringency wash solution and warm it to 49oC. Wash the blot for about 30 seconds and discard the wash solution. This step uses a high-stringent solution to further refine the desired DNA by removing closely homologous hybridizations.
- Check the blot for activity with a Geiger counter. Readings of 10-50 counts per second with bands of irradiation peaks are desirable. If the background is too high, wash the blot again with 1X wash solution.
Detection of probe
- Place the blot in a film cassette lined with new saran wrap and carefully wrap the blot ensuring no air bubbles are trapped between the blot and the wrap.
- Carry the cassette to the darkroom and place the X-ray film over the blot. Lock the cassette and place it at -80 °C overnight. Develop the film the following day.
- Another sheet of X-ray may be placed over the blot and returned to -80 °C for another exposure.
Northern Blotting Protocol
The protocol for Northern blotting is similar to that of Southern blotting. However, RNA sequences are separated on denaturing agarose gel incorporated with formaldehyde.
Isolation of RNA
- Isolate RNA from cells or tissue samples using the TRI Reagent® (T9424) or GenElute™ kit for mammalian cells or tissues (RTN70, RTN10 and RTN350).
- To determine the quality and concentration of RNA, read the absorbance of the samples at 260 nm and 280 nm. The ratio of absorbance, A260/A280 of 1.8-2.1 indicates good quality RNA.
Gel electrophoresis
- Load the samples carefully into the wells using pipettes. A suitable marker containing RNA fragments of various sizes (R7020, R7644) may also be loaded, if required.
- For a detailed protocol on denaturing RNA in agarose gel electrophoresis, refer to the Introduction to Nucleic Acid Electrophoresis
If ethidium bromide has been incorporated into the agarose prior to electrophoresis, the gel image can be acquired immediately after the run.
Transfer
The transfer setup, prehybridization, hybridization, and detection protocols are the same as those for Southern blotting.
Materials
Reference
To continue reading please sign in or create an account.
Don't Have An Account?