溶壁酶的酶学测定
描述
本操作程序可用于使用面包酵母作为底物测定溶壁酶的活性。比浊测定法 [800 nm处的吸光度(A800),光程 = 1cm] 基于以下反应:

单位定义:一个单位的溶壁酶在pH 7.5、25 ℃下,使用酵母悬液作为底物,在3 mL反应混合物中每分钟产生0.001 ΔA800。
所需试剂和设备
- 1 M磷酸氢钾溶液(货号:P8709)
- 1 M磷酸氢二钾溶液(货号:P8584)
- 来自酿酒酵母的酵母(货号YSC1)
注意事项 — 有关有害物及其安全处理方法的信息,请参阅安全数据表。
制备说明
使用超纯水(25 °C时≥18 MΩxcm电阻率)制备试剂。
磷酸盐缓冲液(67 mM磷酸钾缓冲液,pH 7.5,25 °C)— 制备100 mL:
- 将1.33 mL 1 M磷酸二氢钾溶液(货号P8709)移液到合适的烧杯中。
- 加入5.37 mL 1 M磷酸氢二钾溶液(货号P8584)。
- 用超纯水稀释至100 mL。
- 用1 M KOH调节至pH 7.5。
底物 [0.4%(w/v)面包酵母悬液(来自酿酒酵母的酵母)] —
用研钵和研杵研磨适量的酵母(货号:YSC1),得到至少800 mg的粉末。研磨粉末的细度应在25-30目之间。
用粉末在超纯水中制备4 mg/mL酵母悬液。
搅拌溶液,搅拌速度尽量不产生涡旋。在室温下混合约1小时。
注意:搅拌速度过高可能导致酵母细胞过早溶解。1小时后,停止搅拌,静置30分钟以使较大的沉淀物沉降。小心地将上部三分之二的上清液倒入新的烧杯中。去除较大的沉积物将在测定时使分光光度计读数的噪音最低。
在运行测定之前必须检查确认底物浓度。
a. 移取以下试剂到合适的比色皿中:
b. 测量酵母混合物的A800与超纯水的比较。ΔA800 [ΔA800(底物) = A800(底物) – A800(空白)]必须在0.7 –1.0之间。如有必要,使用适量的酵母粉或超纯水调整吸光度。
在整个测定过程中,在室温下缓慢混合底物(尽量减小涡旋)。该混合物可以稳定8小时。
酶溶液 — 制备10 mg固体/ml溶壁酶溶液。仅在使用前,制备二次稀释液以便校正的ΔA800/min落在0.025和0.035之间。如果速率超出此范围,则适当二次稀释液,并重新执行上述步骤。
说明:
有些粗制的溶壁酶产品,可能需要15分钟以上时间才能溶解。进行1-15秒的短时超声处理有助于溶解酶而不影响酶活性。
如果校正的吸光度小于0.025,则增加酶的浓度,以使校正吸光度达到0.025-0.035。
如果校正的吸光度大于0.035,则减小酶的浓度,以使校正吸光度达到0.025-0.035。
操作流程
在3.00 mL反应混合物中,最终浓度为:34 mM磷酸钾,~0.12%(w/v)面包酵母和25-35个单位溶壁酶。
将下列试剂移至合适的容器中:
倒置混合测试和空白比色皿,并平衡至25 ℃。然后加入酶溶液:
立即倒置混合空白和所有测试样品。按顺序执行此操作程序以捕获底物的稳定效果。记录A800吸光度的降低~10分钟。
在2分钟的时间段内,使用每个测试的最大线性速率获得ΔA800/min。每个测试速率都需要使用空白样的相应时间范围进行校正。
校正的ΔA800/min必须介于0.025和0.035之间,才能使测定有效。如果速率超出此范围,则适当调节酶浓度,并重新执行上述步骤。
结果
计算
1.

式中:
df = 酶的稀释因子
0.001 = 根据单位定义在800 nm处的吸光度变化
0.050 = 反应中使用的酶溶液的体积(mL)
2.
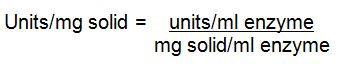
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?