Ni-NTA-Atto共轭物
Ni-NTA-Atto共轭物 ,用于灵敏、特异地检测多聚组氨酸标签蛋白
最先进的重组蛋白应用需要可靠的检测方法。多聚组氨酸是重组蛋白中最常用的亲和标记物之一。它可以插入 N 端或 C 端,并在多种宿主中表达。由于其体积较小,多组氨酸标记物可作为蛋白质纯化和检测的适用工具。免疫印迹法检测 His 标记的融合蛋白通常使用多聚组氨酸的抗体,然后使用与诸如辣根过氧化物酶或碱性磷酸酶的酶偶联的第二抗体。然后用合适的酶底物检测蛋白质。
Ni-NTA-Atto共轭物为 His 标记的融合蛋白提供特异性和高灵敏度的检测。Ni-NTA-Atto 复合物(Nα,Nα-双(羧甲基)-L-赖氨酸,与 Atto 染料结合的镍 (II) 复合物)对多组氨酸标记物具有特异性,交叉反应性最小。Atto染料在通常可用的波长下提供强荧光信号并且几乎没有猝灭。Ni-NTA-Atto共轭物可直接应用于 SDS-PAGE 凝胶或 Western blot 膜进行荧光成像,并已成功用于活细胞。1,2 使用Ni-NTA-Atto共轭物进行检测所需的孵育时间比蛋白质-抗体结合更少。不需要二次反应,因为 Ni-NTA 复合物直接与荧光团结合。与传统的免疫检测方法相比,这种方法更快速、更灵活(参见图 1)。
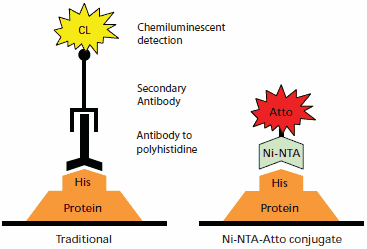
图 1.传统抗体化学发光免疫检测(左)与 Ni-NTA-Atto 结合物检测(右)的蛋白检测比较。免疫检测发生在蛋白印迹后的转移膜上,而 Ni-NTA-Atto 结合物可以与转移膜一起使用,也可以在固定后直接在 SDS-PAGE 凝胶上使用。
在 SDS-PAGE 凝胶上直接检测组氨酸标记蛋白
将 Ni-NTA-Atto 偶联物直接应用于 SDS-PAGE 凝胶,为在不同时间点监测蛋白纯化或蛋白表达提供了快速、简便的检测方法。使用荧光成像观察到His标记的p38 MAPK的检测限为50ng(见图 2)。
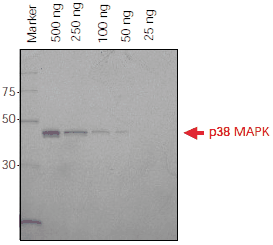
图 2.在 4-20%Tris-甘氨酸 SDS-PAGE 凝胶上分离 His 标记的 p38 MAPK 蛋白 (500 ng–25 ng)。将凝胶在 40% 乙醇/10% 乙酸中固定过夜,在水中洗涤并在黑暗中与 Ni-NTA-Atto 647N (1:1000) 一起温育。洗涤凝胶,然后使用具有633 nm激发和675 nm发射滤光器的FLA-3000 Fuji® 激光扫描仪成像。Ni-NTA-Atto 647N(λex 647 nm, λem 669 nm)在光谱的红色区域被激发。
免疫印迹法检测组氨酸标记蛋白
电泳后,蛋白可能会从 SDS-PAGE 凝胶转移到低荧光 PVDF 膜上,处理起来更加稳健。传统的蛋白质印迹法适用于多聚组氨酸标记物,但比较费时。Ni-NTA-Atto共轭物同时具备高度特异性检测和更快速的优点。
将Ni-NTA-Atto共轭物应用于膜可获得与直接凝胶检测相当的灵敏度。干燥膜可增强信号强度(参见图 3)。另外,Ni-NTA-Atto共轭物可以在 20 mm EDTA 中孵育 60-90 分钟后从使用过的膜上剥离下来。

图 3.在 4-20%SDS-PAGE 凝胶上分离 His 标记的 p38 MAPK 蛋白 (500 ng–25 ng)。将蛋白转移到低荧光 PVDF 膜上,用 PBS 中的 5%BSA 封闭过夜,用 PBS-T 漂洗,并在黑暗中与 Ni-NTA-Atto 647N (1:1000) 一起温育。清洗膜,然后使用 FLA-3000 Fuji® 激光扫描仪成像,激发波长为 633 nm,发射滤光片为 675 nm。
传统的 Western 免疫印迹和Ni-NTA-Atto共轭物的步骤比较见表 1。直接 SDS-PAGE 凝胶检测最方便,因为它省略了转移步骤。与 SDS-PAGE 凝胶相比,Western 印迹膜观察到与Ni-NTA-Atto共轭物相似的检测限,但没有凝胶损坏的风险。无论哪种情况,动手操作时间都少于传统抗体技术。
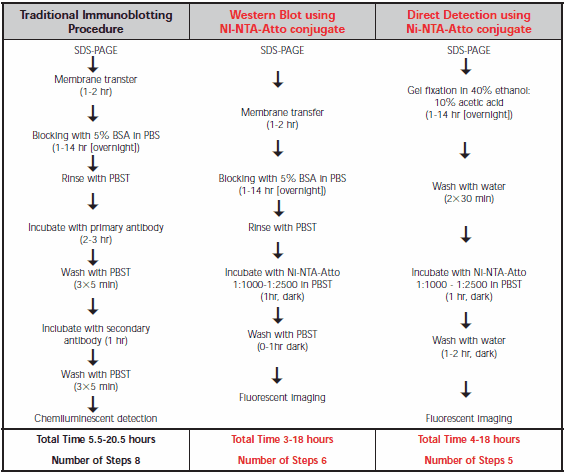
表1.传统 Western 免疫印迹、使用Ni-NTA-Atto共轭物的 Western 印迹和使用Ni-NTA-Atto共轭物在 SDS-PAGE 凝胶上直接检测的方案比较。Ni-NTA-Atto 原液是通过将 250 μg 溶于 250μlpbs 中制备的。
Ni-NTA-Atto 偶联物为传统抗体免疫检测提供了一种有价值的替代方法,用于特异性和灵敏地检测 His 标记的融合蛋白。Ni-NTA-Atto 的使用减少了实验时间,省去了耗时的抗体验证实验,既节省时间又节省费用。
材料
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?