寡核苷酸纯化
在制造DNA期间,每个核苷酸通过亚磷酰胺试剂顺序偶联至生长链。在每个偶联循环中,低百分比的寡核苷酸链不延伸,导致全长(n)和截短(n-1、n-2等)序列('短序列')的混合物。此外,小分子杂质是切割和去保护过程的副产物。
在切割、去保护和脱盐(除去小分子杂质)后,额外的纯化可以将所需的全长序列与不需要的短序列分开。具体技术/应用所需的纯度(表1)取决于由于短序列的存在造成的潜在问题。
此外,包含共修饰(例如生物素、氨基C2dT等)的寡核苷酸,可以使用下述任何方法纯化。对于含有更复杂染料结构(例如ROX™、TxRd(磺酰罗丹明101-X)等)的寡核苷酸,HPLC是首选方法,只有它可以去除游离染料,这些游离染料会影响拟进行的技术/应用的性能。
方法
脱盐
每个寡核苷酸都是免费脱盐的。
脱盐除去小分子杂质,例如由磷酸二酯骨架脱保护产生的丙烯腈,它是来自切割和去保护的残余副产物。对于许多技术/应用,包括PCR,脱盐对于≤35个碱基的寡核苷酸是可接受的,因为全长序列的数目占绝大多数,它们的贡献超过了短序列的贡献(了解更多关于产量计算的信息)。多于35个碱基的寡核苷酸可能需要额外的纯化,例如反相处理柱纯化。
由于这个方法不能除去短序列,因此只做脱盐纯化不能保证纯度水平。
柱式
反相纯化柱的分离功能提供了更高的纯度(图1)。分离的基础在于全长序列(具有疏水性5’-DMT基团)与短序列(没有5'-DMT基团)之间的疏水性差异。全长序列被截留在柱上,而短序列则被洗掉。处理柱上的5'-DMT被切割后,预期的全长序列就会被洗脱和回收。另外,在5'末端用某些染料(例如Cyanine或WellRED)修饰的寡核苷酸,适合用纯化柱纯化,因为染料的植入增加了疏水性。
随着寡核苷酸长度增加,含有5'-DMT基团的短序列(未加帽序列产生的产物)的数量比例趋于增加。这些不需要的序列无法用纯化柱除去,因此,对于较长的寡核苷酸,推荐使用高效液相色谱(HPLC)或聚丙烯酰胺凝胶电泳(PAGE)。
纯化柱纯化不能保证纯度水平。然而,多年的经验表明,65-80%的全长序列(通过分析型HPLC)很常见。
RP-HPLC
反相高效液相色谱(RP-HPLC)的工作原理与反相纯化柱相同(图1)。但是,更高的分离度可实现更高的纯度水平。RP-HPLC是纯化结合有染料的寡核苷酸的有效方法,因为它们固有的疏水性非常好地把所需序列与没有染料的序列(也就是短序列)以及有缺失的短序列分开。进一步来说,由于色谱柱的容量和分离性能,RP-HPLC是大规模合成的首选方法。然而,基于疏水性的分辨率随着寡核苷酸的长度增加而降低。因此,通常不推荐RP-HPLC用于纯化>50个碱基的寡核苷酸。尽管使用该方法可以纯化较长的寡核苷酸(可长达80个碱基,在某些情况下更长),但纯度和产率可能会受到不利影响。
标准RP-HPLC可实现>85%全长序列的纯度(通过分析型HPLC)。根据序列的性质,也可实现更高的纯度水平。有关RP-HPLC所能提供纯度的确切性质和任何相关费用,请与您当地的销售或客户服务专家联系。
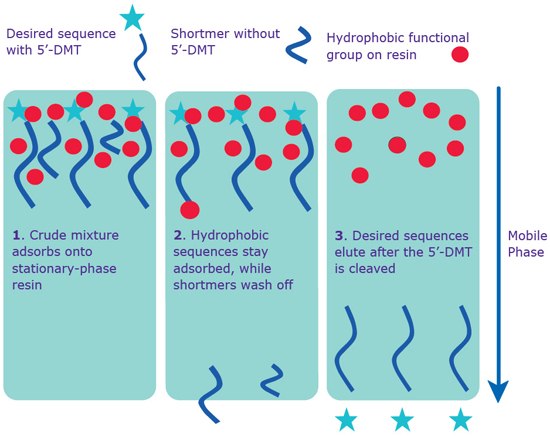
图 1.通过反相技术进行分离:纯化柱和HPLC。标准纯化柱和RP-HPLC纯化技术均使用序列上的5'-DMT进行。
1) 所需序列的疏水性5'-DMT在进入色谱柱后,吸附到固定相树脂上。
2) 没有5'-DMT且因此不能与树脂相互作用的短序列被流动相洗掉。
3) 切割5'-DMT,洗脱所需的序列。
IE-HPLC
离子(具体而言是阴离子)交换高效液相色谱(IE-HPLC)基于寡核苷酸骨架中的带电基团(磷酸盐)的数量。阴离子交换法涉及在季铵固定相上使用盐梯度流动相(图2)。该分辨率非常适合于量少的纯化。然而,IE-HPLC受长度限制,通常不超过40个碱基。更长的寡核苷酸导致全长序列和短序列之间的分辨率较低,从而纯度较低且不一致。
与RP-HPLC相反,使用IE-HPLC的主要目的是纯化具有显著二级结构的寡核苷酸,一般用于具有高GC含量的序列。IE-HPLC对这种寡核苷酸是有效的,因为流动相具有强碱性pH,其破坏氢键,从而破坏二级结构。使用该技术处理之后,可以使用RP-HPLC作为分离过程的备用方案。
请查询有保证的全长序列百分比是多少。
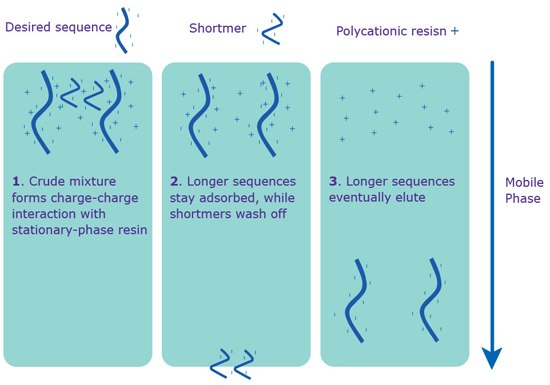
图 2.通过IE-HPLC进行分离。在序列上没有5'-DMT的情况下进行IE-HPLC纯化。
1) 原始混合物的聚阴离子磷酸盐进入色谱柱后,与聚阳离子固定相树脂形成电荷间的相互作用。
2) 随着流动相的离子强度增加,短序列被洗掉。
3) 所需的较长的序列最后以更高的离子强度洗脱。
聚丙烯酰胺凝胶(PAGE)
聚丙烯酰胺凝胶电泳(PAGE)使用变性环境,基于分子量而不是电荷分离寡核苷酸(图3)。在适当的条件下,可以分辨出有单个碱基差异的寡核苷酸。这种优异的大小分辨率所获得的纯度通常是其他可用的纯化方法中最高的。由于提取寡核苷酸的程序复杂,PAGE的最小产量低于其他方法。当需要高纯度及处理≥50碱基的序列时,建议使用该技术。
PAGE通常可实现>95%全长序列的纯度。有关PAGE所能提供纯度的确切性质和任何相关费用,请与您当地的销售或客户服务专家联系。
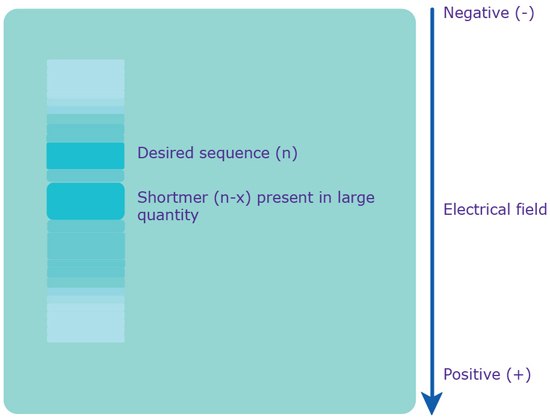
图 3.通过PAGE进行分离。向凝胶施加电场,这使得聚阴离子寡核苷酸移动到带正电荷的阳极。由于电荷均匀分布在原始混合物中,因此基于分子量(即长度)来分离各种序列。短序列移动得较快,而所需的较长序列则移动得较慢。
凝胶过滤
建议将凝胶过滤用于拟在体内试验使用的少量寡核苷酸(图4)。根据制造地点的不同,通常用于体内反义研究的硫代磷酸酯寡核苷酸(S-Oligos)可能可经过凝胶过滤(请与您当地的销售或客户服务专业人员联系,以查看您所在地区是否可以使用此处理方法)。这种纯化方法能够除去痕量合成、切割和脱保护副产物(未通过标准脱盐除去)以及纯化溶剂。这些痕量副产物在体外通常是无害的,但在体内可能会导致细胞毒性作用。
我们的较大量产品iScale Oligos™可提供更多的体内产品选择。
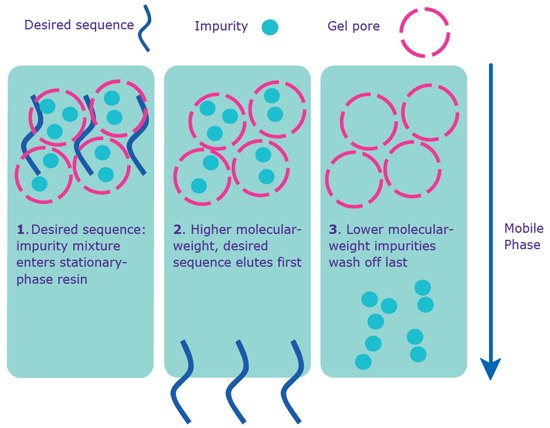
图 4.通过凝胶过滤进行分离。在序列上没有5'-DMT的情况下使用凝胶过滤纯化。
1) 所需序列与各种副产物和溶剂杂质的混合物进入色谱柱后,穿过固定相树脂。
2) 随着流动相的流动,较小的杂质进入凝胶孔,从而减缓它们通过基质的进度;所需的序列不会进入凝胶孔,因此首先通过基质进行洗脱。
3) 杂质最终通过凝胶孔和基质并被洗掉。
二代测序寡核苷酸
上述传统的纯化方法可有效去除小分子杂质,将全长序列纯度提高到所需水平。随着极其敏感的技术(例如新一代测序,NGS)的应用与发展,出现了另外一种杂质,即交叉污染。传统的纯化方法不能有效去除交叉污染的寡核苷酸。
在任何高通量寡核苷酸制造设施中都存在少量交叉污染。通常,这种少量对传统技术/应用(例如PCR)没有可辨别的影响。但是,大多数NGS平台依赖索引(条形码)适配器进行多路复用。如果将少量错误的条形码(由于交叉污染)添加到错误的测序目标中,则在数据分析阶段之前该问题是不可检测的,这使得该问题在时间和金钱上造成高昂代价。
为避免这一问题,已经开发出新一代测序寡核苷酸(NGSO)。NGSO使用专有的纯化方法制造,推荐用于任何用作NGS适配器的寡核苷酸。
结论
根据预期用途,最好通过不同方法或方法组合纯化寡核苷酸。首先,请参阅表1,了解给特定技术/应用推荐的纯化方法。如果需要其他帮助,请通过oligotechserv@sial.com咨询我们的技术服务组。
如要继续阅读,请登录或创建帐户。
暂无帐户?