自噬分析
简介
自噬是一种高度调节的稳态降解过程,其中细胞通过溶酶体机器破坏并回收自身组分。该过程与多种疾病相关,其中包括阿尔茨海默病1、衰老2、癌症3以及克罗恩病。通过与促凋亡信号转导途径的广泛交互,自噬也可导致细胞死亡并极大地影响一般细胞的健康。自噬的功能失常会影响细胞的寿命和生产力,从而使细胞无法以正常功能运转。阐明自噬与凋亡细胞死亡之间的相关性已成为大量研究的焦点,特别是在肿瘤生物学中。一方面,自噬可能通过降解必需成分诱导细胞死亡;另一方面,它可以促进癌细胞在不利的代谢条件下的存活4。
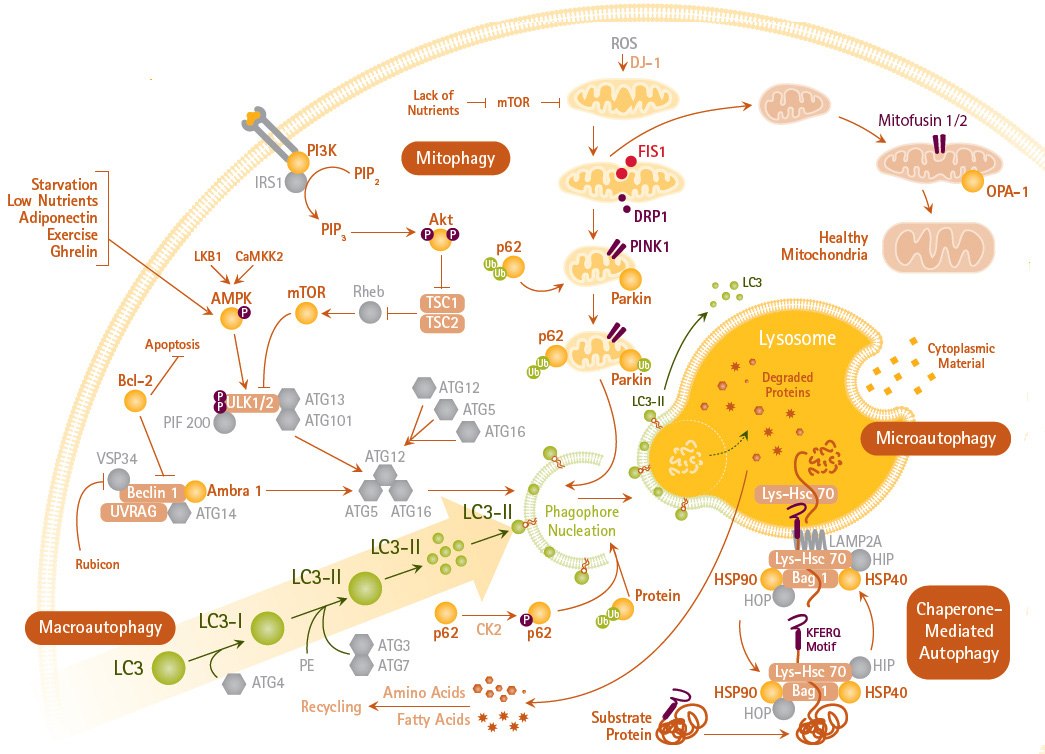
图 1.自噬机制和信号转导途径。自噬(包括巨自噬、线粒体自噬和微自噬)是细胞内的降解系统,通常由LC3介导向溶酶体递送细胞质成分。
图 2.活细胞LC3慢病毒荧光生物传感器
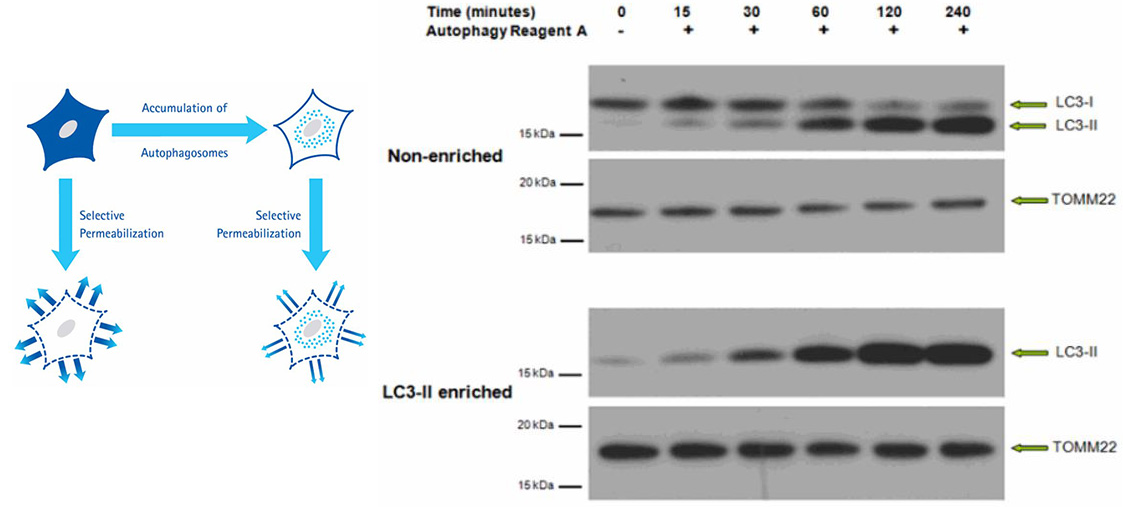
图 3.使用LC3-II富集试剂盒制备的来自HeLa细胞的非富集裂解物和富含LC3-II的蛋白组分的免疫印迹结果。将蛋白进行SDS-PAGE并转移至PVDF膜上。利用抗-LC3和抗-TOMM22的一抗对膜进行标记,然后再用二抗进行检测。通过增强的化学发光获得蛋白印迹。非富集裂解物的免疫印迹结果表明,随着LC3-II信号增加,LC3-I的信号在诱导自噬后随时间降低。富集后,不再检测到LC3-I的信号,但LC3-II的信号得到保留。
流式细胞术自噬检测
FlowCellect™GFP-LC3报告基因自噬分析试剂盒为使用流式细胞术研究自噬和检测自噬诱导剂效能提供了定量解决方案。该试剂盒具有四个独特的功能:
- 使用专有的选择性透化溶液可通过提取可溶性胞质蛋白,来区分细胞溶质LC3与自噬LC3,同时保护已被招募至自噬体中的LC3;
- 使用单体GFP作为报告基因可促进融合蛋白的易位,由于其他形式的GFP在细胞中过表达时易形成二聚体和聚集体,因此难以从细胞质中提取并且不可能通过流式细胞术进行易位检测;
- 由于自噬是组成型细胞降解过程,因此使用自噬检测试剂将阻止LC3的溶酶体降解,从而允许通过流式细胞术进行定量。
- 在我们的LC3融合蛋白中使用的单体GFP与蛋白的5'末端(N-末端融合)相连,其可以保护GFP免于Atg4的切割,从而使得其在自噬体内可见。
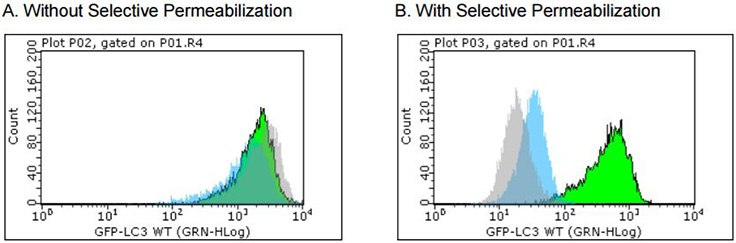
图 4.GFP-LC3稳定的报告基因细胞系,用于检测自噬速率和进行药物筛选。在(A)中,没有经过选择性透化,在饥饿(诱导自噬)之前和之后使用流式细胞术检测不到GFP-LC3水平的变化。直方图的位置表明细胞质中GFPLC3的高水平表达。在(B)中,经过选择性透化,当在溶酶体抑制剂(绿色)存在下饥饿时,GFP-LC3水平在自噬体中仍然很高;即使在没有抑制剂的情况下,当饥饿(蓝色)时观察到轻微的变化。如果饥饿(灰色)条件下未诱导自噬,则所有细胞溶质中的GFP-LC3都被洗去。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?