亲和层析缓冲液置换和脱盐
透析在文献中常被用作一种去除盐或其他小分子并置换样品缓冲液成分的技术。不过,透析的过程通常极其缓慢,需要使用大量的缓冲液。在处理期间或由于蛋白降解或与透析膜的非特异性结合,存在丢失样品的风险。一种更简单、更快速的技术是使用填充有Sephadex G-25的脱盐柱,对高分子量物质和低分子量物质进行分离。利用该方法,可以将蛋白质与盐和其他小分子分离。
该方法只需快速单步即可将样品进行脱盐,从而转移到新缓冲液中,并去除低分子量物质。
脱盐柱不仅可用于除去低分子量的污染物(例如盐),而且还可在不同层析步骤前后进行缓冲液的置换,然后快速除去相关试剂以终止反应。
该方法可以处理高达脱盐柱总体积的30%的样品体积。只要蛋白浓度在使用普通水性缓冲液时不超过70 mg/mL,样品浓度就不会影响分离。该过程需确保样品应完全溶解。可以通过离心或过滤以除去样品中的颗粒物质。
如果样品体积过小,可用后续用于层析纯化的缓冲液对样品进行稀释,但仍必须保证除去样品中的细胞碎片和颗粒物质。
为了防止可能的离子相互作用,建议在脱盐期间和最终样品缓冲液保持低盐浓度(25 mM NaCl)。
如果需要避免NaCl的存在,可以使用挥发性缓冲剂,例如100 mM乙酸铵或100 mM碳酸氢铵。
图76显示了典型的缓冲液置换和脱盐分离结果。可以通过跟踪UV吸光度和电导率变化来监测该过程。
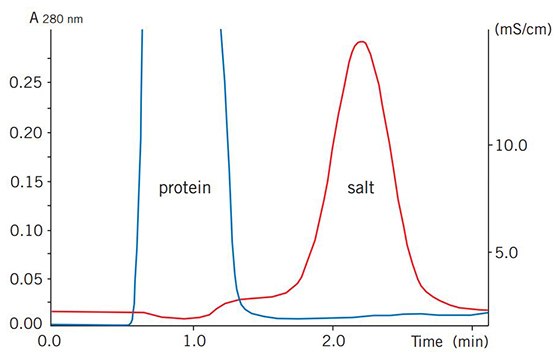
图 76.在HiPrep™ 26/10脱盐柱上,小鼠血浆(10 mL)的缓冲液置换结果。
对于实验室规模的操作,表16列出了预包装、即用型脱盐柱和缓冲液置换柱的选择指南。
对更大体积的样品进行脱盐:
- 最多连接5个5 mL的HiTrap®脱盐层析柱,以增加样品容量,例如: 2个柱子可上样样品体积为3 mL,5个柱子的可上样样品体积则为7.5 mL。
- 最多连接4个HiPrep™ 26/10脱盐柱,以增加样品体积容量,例如:2个柱子可上样样品体积为30 mL,4个柱子的可上样样品体积则为60 mL。即使串联4个层析柱,样品也可以在室温下,在水性缓冲液中,20到30分钟内处理完成。
每个层析柱都附带有使用说明。每个样品的脱盐和缓冲液置换过程,可能需要不到5分钟,并且大多数蛋白质的回收率大于95%。
备选方案1:使用加样针进样5 mL HiTrap®脱盐柱进行手动脱盐
- 在加样针中注入缓冲液。取下止动塞。为避免将空气引入层析柱,通过"点接触"将层析柱连接至加样针(利用提供的转接头)。
- 打开层析柱封闭的一端。
- 用25 mL缓冲液以5 mL/min的流速洗涤柱子以完全除去柱内的20%乙醇(作为储存缓冲液提供)。果有空气滞留在脱盐柱中,应使用脱气缓冲液清洗至空气消失。在进样期间偶然引入到柱上的气泡不会影响分离。
- 使用2-5 mL加样针以1-10 mL/min的流速进样。弃去从脱盐柱洗脱出的液体。
- 如果样品体积小于1.5 mL,则更换为缓冲液并继续进样,直至所有1.5 mL均被洗脱出来。弃去洗脱出来的液体。
- 根据表16选择适当的缓冲液体积洗脱蛋白。
收集所示体积的脱盐蛋白。
注意:使用5 mL HiTrap®层析柱时,5 mL/min对应约120滴/min。也可将一个简单的蠕动泵用于注射样品和缓冲液。
建议的最大样品体积为1.5 mL。有关减少进样体积对层析柱的影响,请参见表17。
也可将一个简单的蠕动泵用于注射样品和缓冲液。
备选方案2:使用ÄKTAprimeplus轻松脱盐
ÄKTAprimeplus包含用于单个5 mL HiTrap®和HiPrep™ 26/10脱盐柱的预编程模板。

缓冲液制备
准备至少500 mL所需的缓冲液。
- 按照KTAprimeplus提示卡上提供的说明连接层析柱,并使用缓冲液加载系统。
- 选择应用程序模板。
- 启动方法。
- 输入样品量,然后按OK。
图77显示了利用ÄKTAprimeplus所获得的典型结果。UV(蛋白质)和电导率(盐)曲线便于将脱盐馏分收集在一起。
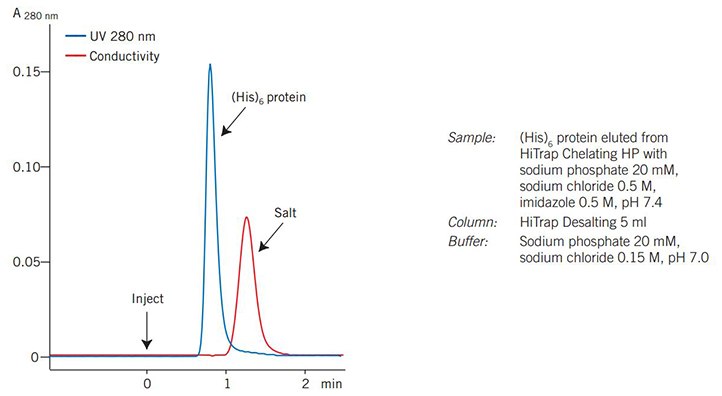
图 77.在ÄKTAprime plus上对(His)6融合蛋白的脱盐结果。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?