通用 SYBR Green qPCR 协议
技术概述
测定注意事项
方法定量方法
设备和耗材
PCR混合物选择指南
Protocol
Troubleshooting
Materials<
参考文献
技术概述:SYBR Green qPCR
随着带有荧光检测功能的热循环仪的发展,PCR 有了新的创新应用。在常规 PCR 中,关键结果是处理后产生的扩增子的最终数量。实时或定量 PCR 和 RT-PCR 利用 DNA 扩增的线性来确定样品中已知序列的绝对或相对数量。通过在反应中使用荧光报告物,可以测量 DNA 的生成量。
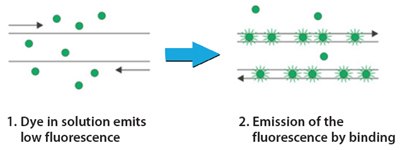
图 1.技术概述:SYBR Green qPCR
在定量 PCR 中,每个 PCR 周期都要对 DNA 扩增进行监测。当 DNA 处于对数线性扩增阶段时,荧光量的增加会超过背景。可测量荧光的点称为定量周期(Cq)或交叉点。通过多次稀释已知量的标准 DNA,可生成浓度对数与 Cq 的标准曲线。然后就可以根据 Cq 值计算出未知样品中 DNA 或 cDNA 的含量。
A) 反应的不同阶段:
基线: 模板的初始浓度较低,因此荧光强度太低,无法检测,只有背景信号明显。
指数: 当目标产率达到检测阈值(如红色阈值线所示)后,可通过指数阶段跟踪反应过程。
线性: 随着模板浓度的增加,可用的 DNA 聚合酶浓度降低,反应速率下降。
高原: 没有足够的游离酶来继续扩增,因此此时之后,反应处于最大产率或高原阶段。
B) 单个反应的特征是荧光首次升至阈值以上的周期,称为定量周期(Cq)。如果起始材料丰富,则在较早的周期就能观察到扩增,Cq 也较低。如果起始材料稀少,则在较晚的循环中观察到扩增,Cq 较高。荧光、Cq和扩增产物量之间的这种相关性可以在很宽的动态范围内对模板进行定量。可使用每个待扩增区域特有的引物和不同的荧光染料标记进行反应。一些市售的定量热循环仪包含多个检测通道。在这种多重系统中,目标 DNA/cDNA 的数量可与 GAPDH 或 β-actin 等看家序列的数量进行比较。
NR=不建议使用
X=建议使用
XX=首选方法
检测注意事项
DNA 制备
确保 PCR 成功的唯一重要步骤是高质量的 DNA 制备。
DNA制备
确保 PCR 成功的最重要步骤是高质量的 DNA 制备。DNA 模板的完整性和纯度至关重要。定量 PCR 涉及多轮酶促反应,因此对蛋白质、苯酚/氯仿、盐类、乙二胺四乙酸和其他化学溶剂等杂质更为敏感。污染物也会干扰荧光检测。260 nM 和 280 nM 处的吸光度值之比可估算出 DNA 的纯度。纯 DNA 的 A260/A280 比值为 1.8-2.0。
模板
启动 qPCR 需要极少量的目标核酸拷贝(相当于约 100 pg gDNA 或 cDNA)。为尽量减少反应抑制剂的污染,起始模板量应保持在实现精确定量所需的最低水平。当起始材料为 RNA 时,引物设计和 DNase I 处理将减少 gDNA 污染可能产生的信号。
引物设计
无论是使用 dsDNA 结合染料还是基于探针的检测化学方法,设计高质量的引物都是 qPCR 最关键的实验前步骤之一。应借助引物设计软件设计用于 PCR 的特定引物,以消除引物二聚体和二级结构带来的复杂性。较低的引物浓度可减少引物二聚体的积累和非特异性产物的形成,这对于在定量 PCR 中使用 SYBR Green I 染料至关重要。
dNTPs
标准 PCR/qPCR 母液包含 dATP、dCTP、dGTP 和 dTTP。不过,也有一些混合液用 dUTP 取代 dTTP。以前用 dUTP 运行的反应产物会含有尿嘧啶而不是胸腺嘧啶。这些产物容易被尿嘧啶-DNA-糖基化酶(UNG)裂解。因此,事先用 UNG 对后续反应进行孵育可防止反应间的污染。
镁浓度
氯化镁(MgCl2)是逆转录酶、Taq DNA 聚合酶和 Taq DNA 5' 到 3' 外切酶活性所必需的。含有 DLP 的反应的最佳 Mg2+ 浓度通常在 3 - 6 mM 之间。较低的氯化镁浓度通常会导致形成较少的非特异性产物。有些 ReadyMix 溶液的 2 倍浓度为 7 mM 氯化镁(最终浓度为 3.5 mM)。在某些情况下,还会提供一小瓶 25 mM 的氯化镁溶液,以便在必要时进一步优化氯化镁的最终浓度。有时可能需要不含氯化镁2 的反应混合物,以便使用低浓度,例如在使用蝎子探针检测时。
反转录酶
能提供高产率 cDNA 并在高温下保持活性的反转录酶对 RT-qPCR 的成功至关重要。在高温下保持活性有助于确保具有重要二级结构的 RNA 区域不稳定,便于杂交和后续扩增。在进行一步式 RT-qPCR 时,高温性能允许使用具有高熔化温度 (Tm) 的基因特异性引物,从而提高反应的特异性。在执行两步方案时,必须确保酶能从 RNA 中得到线性和成比例的 cDNA 产物。尽量减少移液可以降低变异性。有些 ReadyMixes 含有进行 RT 所需的引物和其他试剂,例如 ReadyScript® cDNA Synthesis Mix (RDRT)。
Taq DNA 聚合酶
就像为 RT 选择最合适的逆转录酶一样,选择合适的酶也至关重要。天然 Taq DNA 聚合酶的一个基本问题是该酶在低温下有残余活性。由于这种聚合酶的残余活性,非特异性引物结合会导致非特异性产物的形成。抗体阻断或化学阻断 Taq DNA 聚合酶("热启动")有助于纠正这种情况,在高温变性步骤开始之前阻止酶的活性。请参阅《PCR 混合液选择指南》,确定最适合您应用的热启动聚合酶。
按仪器类型划分的内部参考染料
有些 real-time PCR 热循环仪需要 ROX 等上载染料,以控制光学系统的可变性,并使信号强度的差异正常化。同样,有些热循环仪需要荧光素,以便在使用 SYBR Green I 染料检测(背景非常低)时产生虚拟背景。这些荧光素可以在 ReadyMix 中提供,也可以作为单独的成分提供,以便使用适当的浓度。在某些情况下,还包括一小瓶内部参比染料用于反应归一化。该染料的最大激发为 586 nM,最大发射为 605 nM。ROX 参考染料的标准仪器设置可满足内部参考染料的测量要求。这种内部参比染料对于 ABI 序列检测系统是必需的。
仪器
需要选择与仪器兼容的试剂。平台使用不同的归一化染料,因此需要选择与归一化染料兼容的试剂(参考 附录 1)。
许多 qPCR 仪器都是为支持特定范围的应用而设计的,例如,ABI 7900 具有自动装载 384 孔板的高通量能力,而 Illumina Eco 仪器支持单个 48 孔板。最合适的仪器能满足研究需要。最好是选择具有用户友好型软件的仪器,该软件可执行最理想的功能,并在数据输出方面具有灵活性,以便于在下游统计分析软件包中进行操作。这样可以减少人员培训所需的时间,从而减少开始生成结果所需的时间。所需的其他功能还包括绝对均匀的 PCR 块(96 孔复制中 1Cq = 2 倍的绝对最大偏差),以及在宽波长范围内尽可能灵敏、均匀地激发和检测发射的光学系统。这样就可以选择多种荧光团,实现多路复用。其他需要考虑的因素还包括与特定消耗品相关的操作成本,例如,如果反应中不使用标准微孔板,装载非标准格式的板/管是否方便。无模板/阴性对照是确定是否存在污染所必需的。
缓冲液
缓冲液或反应母液通常包含 dNTPs、Taq DNA 聚合酶、MgCl2和稳定剂。根据检测化学、仪器和反应要求的不同,还可能包括 SYBR Green I、ROX™、荧光素和惰性负载染料。PCR 缓冲液成分和稳定剂通常为制造商专有。如果单独购买,则可以获得最大的灵活性,因为每种成分都可以在反应中单独优化。然而,与此相反,将这些成分作为母液一起购买虽然降低了灵活性,但却提高了批次的一致性和便利性,同时减少了移液步骤的数量,从而降低了出错和污染的几率。
数据分析
请遵循用于进行 SYBR Green PCR 定量分析的实时仪器的建议。以下内容可能会对新仪器用户有所帮助。一般情况下,循环数与荧光值相对应。阈值循环(CTs)或交叉点用于确定每个样品中的模板量。阈值循环或交叉点是由于 PCR 产物的形成而导致荧光出现可检测到的增加的第一个循环。交叉点之前的循环为基线循环。基线周期不会显示 PCR 产物导致的可检测到的荧光增加。用于确定荧光首次出现可检测到的增加的阈值也可以手动调整。阈值应始终在对数扩增图上进行。在对数扩增图中,阈值应设置在对数线性范围内,而不是高原阶段。
熔解曲线
在运行结束时进行熔解曲线分析有助于只分析感兴趣的 PCR 产物。按照实时仪器制造商的说明进行熔解曲线分析。可以修改使用相同引物的连续运行,通过在额外的循环步骤中收集数据来消除引物二聚体的形成对产物信号的影响,循环步骤的温度必须介于已确定的二聚体和产物熔化温度(TMs)之间。
定量方法
标准曲线
绝对定量和相对定量都需要标准曲线。生成标准曲线时,应使用不同浓度的 DNA(通常为五种)来生成标准曲线,以括弧表示未知物的浓度。
绝对和相对定量
本 SYBR Green PCR 试剂盒可用于使用绝对或相对定量法对目标 DNA 进行定量。绝对定量技术用于确定初始样本中的目标 DNA 量,而相对定量则是确定目标 DNA 量与参考扩增片段之间的比率。理想的参照扩增片段具有不变的、组成型表达。1
绝对定量使用外部标准来确定目标核酸的绝对量。为了消除退火造成的定量差异,外部标准的引物结合位点必须与目标序列中的引物结合位点相同。理想的外标含有与目标序列相同或仅与目标序列略有不同的序列。要进行绝对定量,目标和外部标准的扩增效率必须相等。一旦确定了合适的构建体或扩增片段,就可生成外标稀释标准曲线,用于确定未知目标样本的浓度。
相对定量法可计算样本中目标模板与参考模板的数量比。由于这种方法测量的是相对于假定不变对照的目标量,因此相对 qPCR 最常用于测量基因多态性差异,例如组织之间或健康样本与疾病样本之间的差异。这种技术的优势在于,使用内标可以最大限度地减少样品制备和处理过程中的变化。
相对定量的准确性取决于标准参考模板的适当选择。1 有些研究人员选择不运行标准曲线,而是将目标量作为参照物的一部分进行报告,这种技术称为比较定量。另一种方法是假定目标物和参照物的扩增效率可以忽略不计,仅根据参照序列确定的标准曲线对目标物进行定量。最后,在最精确的相对定量技术中,要同时测量参照物和目标物的扩增效率,并确定校正因子。这一过程被称为归一化,1 要求样品中含有已知浓度的目标物和参照物,并生成两条标准曲线。
确定 PCR 反应效率
参照物样品和目标物样品之间的 PCR 效率是通过为每个目标物准备一个稀释系列来确定的。从目标样本中减去参照样本的 CT 值,然后将 CT 值的差值与模板量的对数值作图。如果得出的直线斜率小于 ± 0.1,则判断扩增效率相似。
设备
- 定量 PCR 仪器
- 微量离心机
- 用于 PCR 设置的层流罩(可选)
耗材
- qPCR SYBR Green 混合液--请参阅 qPCR 选择指南()。a href="#part1">第 1 部分 和 第 2 部分)
- DNA/cDNA 模板-- cDNA 反应稀释 1:10 以检测中高表达的靶标,或 1:2 至 1:对于罕见转录本或 10 ng 至 100 ng gDNA
- 正向和反向引物稀释至工作浓度(10µM 工作储备液足以进行大多数检测)
- 也可为大多数模式生物提供预先设计的基因表达引物(KiCqStart® SYBR® ;绿色引物, KSPQ12012)
协议协议
制备
- 将所有反应成分置于冰上。
- 混合后短暂离心,收集试管底部的内容物。
标准 SYBR Green I 染料反应
注意:我们观察到,与传统 PCR 相比,在 KiCqStart ReadyMix 中使用更高的引物浓度时,检测效果最佳。在下面的方案中,我们使用 450 nM 的最终浓度,据我们观察,这是多次独立检测的最佳浓度。准备足够的混合母液以重复运行所有样品。确保包括一式两份的无模板阴性对照(NTC)。根据所选 qPCR 试剂,选择适当的下表。计算需要混合的试剂量。添加 10% 的体积,以考虑移液误差
d. 充分混合,避免产生气泡。混合均匀,避免产生气泡
KiCqStart 试剂的主混合物:
用于其他完整 qPCR 预混料的主混合物:
用于其他完整 qPCR 预混料的主混合物:
含单独成分的 qPCR 试剂主混合物:
1 最佳氯化镁2 浓度范围为 1mM 至 6mM。
2 参考 附录 1 以确定仪器的最佳参比染料浓度。
2.设置反应:
a.对于 NTC 反应,在反应管中加入 4 μL 水。对于实验反应,在反应管中加入 4 μL cDNA 溶液。将所有试管短暂离心。目测确认所有试管或孔的底部都含有正确体积的样品。小心地将 16 μL 模板母液等分到每个 qPCR 管或平板孔中。充分混合反应,必要时旋转。盖上试管盖或密封 PCR 板并贴上标签(根据仪器要求)。(确保标签不会遮挡仪器的激发/检测光路)
3.按照仪器制造商的建议运行样品。下面是标准和快速循环的例子。
标准循环参数:
快速循环参数:
故障排除指南
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?