在转移性NSCLC患者接受免疫疗法前多重检测评估血清中的可溶性免疫检查点分子
由于发病率广泛且晚期确诊比例高,肺癌仍然是全球致死率最高的恶性肿瘤之一。PD-1/PD-L1靶向免疫检查点抑制疗法毒性低,并具有突破性和持续性的临床获益,改善了肿瘤治疗格局和患者生存率。美中不足的是,这种治疗策略只能让一小部分患者从中受益。已有研究报道其他多种免疫检查点系统可作为替代治疗方案,但在肺癌中的潜在影响尚未明确。
本研究采用MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2(人免疫肿瘤学检查点蛋白Panel 2多重检测盒),分析了123例晚期非小细胞肺癌患者在接受PD-1/PD-L1靶向治疗前预处理血清样本中的31种免疫检查点分子,包括可溶性检查点分子和免疫调节因子。
了解这些分子的动态及其与临床结局的关联有望推动免疫检查点抑制疗法新策略的研究。评估血清可溶性免疫检查点有助于明确在PD-1/PD-L1免疫疗法中获益的患者,并可为今后的免疫疗法研究揭示新的靶点。
免疫检查点在肿瘤免疫治疗中的作用
免疫系统在肿瘤生物学中起重要的调节作用,可促进或抑制肿瘤的生长和进展1。在癌症研究中,利用免疫系统抵抗癌症是多种治疗方法的重点。免疫检查点抑制剂(ICI)是治疗性单克隆抗体,专门用于破坏免疫检查点调节分子收到的抑制性信号,为一部分转移性黑色素瘤、非小细胞肺癌(NSCLC)等肿瘤患者提供长期生存受益2-4。然而,ICI治疗并不能对所有肿瘤患者起效,说明肿瘤中的免疫调节机制具有异质性5。例如,同一肿瘤中的多种免疫检查点共存使肿瘤免疫治疗的挑战加剧,并可能会造成耐药和治疗失败6。因此,研究掌握这些耐药机制有助于选出最有可能从目前治疗策略中获益的患者,或者为今后的研究揭示新的治疗靶点。
免疫检查点分子是在免疫细胞(主要是T细胞)表面表达的蛋白,用于调节各种抗原(如肿瘤抗原)引起的免疫活化。免疫治疗药物可通过作用于抗原呈递细胞来阻断T细胞活化的抑制信号,增强针对肿瘤抗原的固有免疫应答7。
NSCLC中的PD-1/PD-L1通路
非小细胞肺癌(NSCLC)是最常见的肺癌亚型,目前获批的相关免疫治疗药物的主要靶点是程序性细胞死亡1(programmed death-1, PD-1)及其配体(PD-L1)。其他多种免疫检查点的作用和治疗潜力尚待充分了解。
NSCLC是全球死亡率最高的恶性肿瘤之一,也是在免疫检查点疗法中获益第二多的癌症,尤其是晚期NSCLC8, 9。PD-1/PD-L1免疫检查点通路靶向免疫治疗药物因在一系列临床试验中出色的临床获益记录,已迅速被纳入晚期NSCLC的治疗指南中。然而,对于患者来说,总体治疗反应并不乐观,而且多种耐药机制也已经开始出现,比如替代性免疫检查点分子的表达。
下列研究评估了接受免疫治疗的患者的31种可溶性免疫检查点的外周血水平,并将其与临床结局关联,用于更好地了解NSCLC中其他ICI机制的参与程度。
方法
患者样本人群
采集123例之前含铂双药化疗失败、尚未开始PD-1/PD-L1靶向免疫治疗(比如纳武利尤单抗、阿特珠单抗、帕博利珠单抗或度伐利尤单抗)的晚期NSCLC(IIIb-IV)患者的血清。由Rush University Cancer Center (RUCC) Biorepository(拉什大学医学中心生物样本库)获得每位受试者的书面知情同意书后,前瞻性收集临床数据。临床结局指标如下,从免疫治疗首次用药日期算起:
- 无进展生存期(PFS)是从治疗开始到肿瘤首次发生进展之间的时间。
- 总生存期(OS)是从治疗开始到死亡或患者在生时最后一次随访之间的时间。
本研究所有试验方案均通过拉什大学医学中心(RUMC)机构审查委员审批。
血清采集和保存
在PD-1/PD-L1靶向免疫治疗即将开始之前,使用10mL Vacutainers®红帽真空采血管采集外周血,并用标准的临床实验室方法进行处理。在每份血清样本待用于MILLIPLEX®免疫检测法评估蛋白生物标志物的部分中添加25 µL/mL哺乳动物蛋白酶抑制剂混合物和10 µL/mL的0.5 M EDTA,将处理后的蛋白降解降至最低。等分试样在检测前于-80 °C储存,所有被检标本的冻融次数都不得超过两次。
血清免疫肿瘤学生物标志物水平检测
采用MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2评估血清标本中的31种可溶性检查点分子和免疫调节因子。该panel仅限于研究用途(RUO),不可用于诊断程序。panel靶点包括:
|
|
在Luminex® FLEXMAP 3D®系统上采集所有原始数据点。通过五参数法拟合运算(five-parametric fit algorithm),根据7点曲线计算分析物浓度(xPONENT® v4.0.3软件,Luminex Corp.路明克斯公司,德克萨斯州奥斯汀)。所有数据都符合试剂盒说明书中规定的最低质控标准。
生物标志物统计方法
使用survminer R软件包(3.4版),确定生存参数相关的截断值(Cutoff)。使用Graphpad v.8.3软件进行log-rank对数秩和Kaplan-Meier生存分析,统计显著性门槛定为0.05 p值,评估生物标志物基线水平和临床结局的相关性。
多重检测评估结果
分析性能
采用MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2对治疗前晚期NSCLC患者血清标本中的免疫调节相关分析物进行定量分析。分析的动态范围较宽,达3-4个数量级。平均精密度为94%,样本和标准曲线具有较高的一致性。表1显示各重复的平均变异系数,以%CV(分析内精密度)表示。
表1.各重复的平均分析内精密度值(以%CV表示)。分别计算标准曲线、样本和试剂盒质控品(QCs)各重复的变异系数(CV)。
患者队列表现:无进展生存期
根据队列检测结果,可溶性免疫检查点分子基线值和临床结局的相关性显著。基线血清水平较高的CD40L、B7-H2/ICOSL、APRIL、B7-H5/VISTA、E-钙粘素(E-Cadherin)、半乳凝素-1(Galectin-1)、半乳凝素-3、IDO1、Nectin-2、OX40/CD134和穿孔素(Perforin)与良好的无进展生存期的相关性显著(p值< 0.05)。选定的免疫检查点分子(已定截断值)的Kaplan-Meier生存曲线如图1所示。
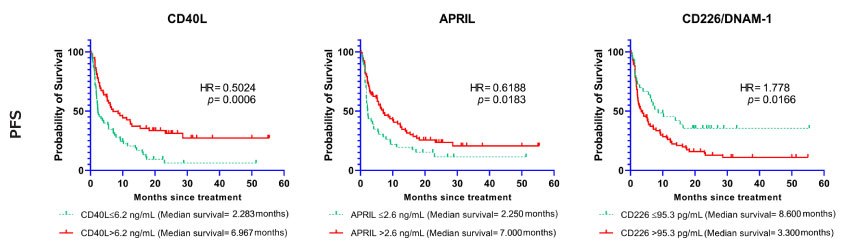
图 1.可溶性免疫检查点(CD40L, APRIL, CD226/DNAM-1)与无进展生存期相关。Kaplan-Meier生存曲线显示选定生物标志物与无进展生存期(PFS)的相关性。曲线分别代表标志物基线值低于或高于截断点的病例。
风险比(HR)和置信区间(95% CI)如表2所示。
表2:可溶性免疫检查点与无进展生存期相关。分析结果与无进展生存期(PFS)的相关性,显示最优截断值、低于(N≤)和高于(N>)截断点的病例数、低于和高于截断点的中位PFS以及对数秩p值。并提供风险比(HR)和95%置信区间(CI)。
患者队列表现:总生存期
很多可溶性免疫检查点也与总生存期结局相关。基线水平较高的CD40L、B7-H2/ICOSL、APRIL、B7-H5/VISTA、E-钙粘素(E-Cadherin)、半乳凝素-1(Galectin-1)、半乳凝素-3、颗粒溶素(Granulysin)、Nectin-2、OX40/CD134和穿孔素(Perforin)与患者较长的总生存期相关(p值< 0.05)。基线水平较低的B7-H3/CD276、5'-NT/CD73、CD226/DNAM-1、FGL1/ Hepassocin、MICA、PVR/CD155和Siglec-7与患者较差的总生存期相关(p值< 0.05)。风险比(HR)和置信区间(95% CI)如表3所示。
表3:可溶性免疫检查点与总生存期相关。分析结果与总生存期(OS)的相关性,显示最优截断值、低于(N≤)和高于(N>)截断的病例数、低于和高于截断的中位PFS以及对数秩p值。并提供风险比(HR)和95%置信区间(CI)。
图2显示总生存期相对选定免疫检查点分子基线截断水平的Kaplan-Meier生存曲线 。
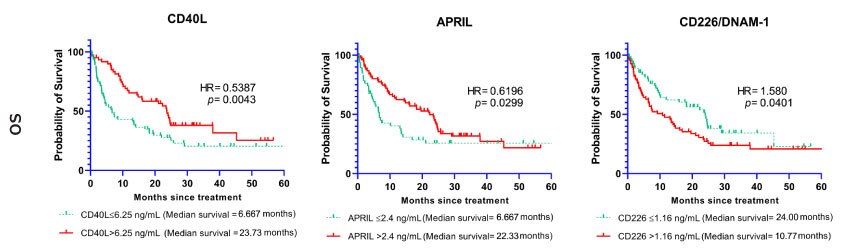
图 2.可溶性免疫检查点(CD40L, APRIL, CD226/DNAM-1)与总生存期相关。Kaplan-Meier生存曲线显示选定生物标志物与总生存期(OS)的相关性。曲线分别代表标志物基线水平低于或高于截断点的病例。
结论
采用MILLIPLEX® Human Immuno-Oncology Checkpoint Protein Panel 2(人免疫肿瘤学检查点蛋白Panel 2)可通过多重检测法评估可溶性免疫检查点分子。此外,循环免疫检查点分子与接受抗PD-1/PD-L1治疗的NSCLC患者样本的反应模式显著相关。
本研究在伊利诺伊州芝加哥市的拉什大学医学中心(Rush University Medical Center)开展。细胞与分子医学科、病理科和拉什生物标志物开发中心(2020)的Imad Tarhoni, M.D., Ph.D., Cristina L. Fhied, M.S., David Gerard, M.S.和Jeffrey A. Borgia, Ph.D.提供数据。2020年,细胞与分子医学系、病理学系和拉什生物标志物开发核心(Rush Biomarker Development Core)。
Vacutainers®是BD公司(Becton, Dickinson, and Company)的商标。
材料
相关MILLIPLEX®检测试剂盒
仅供研究使用,不可用于诊断。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?