癌症中的叶酸代谢
哺乳动物叶酸循环是一个高度复杂但至关重要的过程,用于将一个碳单位转移到氨基酸、核苷酸和其他生物分子上。叶酸不能合成,而需通过饮食获得,主要是水果、蔬菜和强化谷物。膳食叶酸是该循环的基础分子四氢叶酸(四氢叶酸,THF)的起始原料。叶酸被二氢叶酸还原酶(DHFR, EC 1.5.1.3)部分还原为二氢叶酸中间体(DHF)或完全还原为四氢叶酸。THF随后通过多种氧化酶修饰处理,随后作为单碳供体发挥作用(参见图1)。残留的二氢叶酸可回收为四氢叶酸。虽然叶酸和四氢叶酸对许多过程都有贡献,但其中两种代谢通路一直是癌症化疗的关注点所在(见图2)。
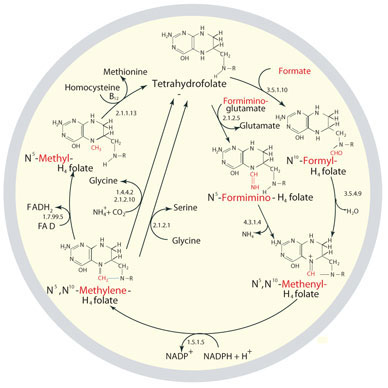
图 1.四氢叶酸的代谢循环和再生。如图所示,THF代谢不是线性的,但可能会根据特定细胞过程的需要转变为产生单碳供体底物。单碳供体分子在图示结构中被染成红色。
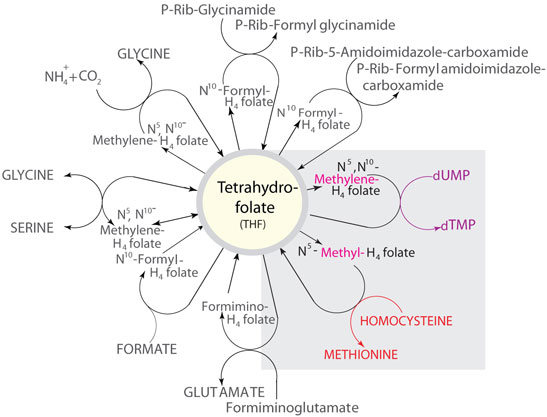
图 2.THF代谢物作为碳供体的一些反应。图示为Nicholson代谢通路图上标明的甲酸C1库,可通过我们网站获取(sigma.com/pathways)。本评论中讨论的相关反应作了突出显示。
叶酸代谢的一个功能是通过生成核酸结构单元来支持DNA合成和修复。该代谢过程从头 合成脱氧胸苷一磷酸(dTMP,5-CH2-dUMP)的过程。首先脱氧尿苷一磷酸(dUMP)通过胸苷酸合酶(EC 2.1.1.45)添加甲基,然后磷酸化为脱氧核苷三磷酸。三磷酸胸苷(dTTP)是DNA合成和修复所必需的四种脱氧核糖核酸之一,三磷酸胸苷的细胞水平限制了DNA的合成。
对DNA合成和修饰重要的其他叶酸代谢通路包括由酶磷酸核糖基甘氨酰胺甲酰转移酶(甘氨酰胺核糖核苷酸转化酶,GAR,EC 2.1.2.2)和磷酸核糖基氨基咪唑甲酰胺甲酰转移酶(5-氨基咪唑-4-甲酰胺核糖核苷酸转化酶,AICAR,EC 2.1.2.3)维持的那些通路。这两种酶为从头合成嘌呤过程提供支持,以生成腺嘌呤和鸟嘌呤的前体,而腺嘌呤和鸟嘌呤是合成脱氧腺苷三磷酸(dATP)和脱氧鸟苷三磷酸(dGTP)这两个DNA构建模块所需的核苷酸碱基。
第二个重要的叶酸代谢反应是通过5-甲基-THF-高半胱氨酸S-甲基转移酶(EC 2.1.1.13)的作用将同型半胱氨酸转化为氨基酸甲硫氨酸。其中一些再生蛋氨酸随后通过酶甲硫氨酸腺苷转移酶(ec2.5.1.6)与ATP一起转化生成S-腺苷甲硫氨酸(SAM或SAdoMet)、磷酸盐和二磷酸。S-腺苷甲硫氨酸是甲基转移酶的关键底物,参与脂质、多肽等生物分子的100多种甲基化反应。DNA的甲基化是利用S-腺苷甲硫氨酸作为甲基供体的一种重要的表观遗传修饰。因此,叶酸及其代谢是正常和恶性细胞合成和修复DNA,以及随后甲基化DNA和其他生物分子所必不可少的。
干扰叶酸代谢对快速分裂的细胞有较大的毒性作用,如红细胞、骨髓细胞、胃肠道细胞、恶性细胞等。由于叶酸代谢是细胞复制和存活所必需的,因此尽管有一定毒性且应用领域有限,它作为代谢抑制剂的化合物已成功用作抗肿瘤治疗药物。第一种抗叶酸药物氨蝶呤是叶酸类似物(4-氨基叶酸),可抑制二氢叶酸还原酶,阻止叶酸和二氢叶酸还原为THF。甲氧曲酸(Methoxtrexate,MTX)是叶酸的另一种类似物,仍在用作直接抑制二氢叶酸还原酶以及抑制胸苷酸合酶的抗肿瘤化疗药物。鉴于对甲氨蝶呤已产生耐药性,已经筛选了许多抑制二氢叶酸还原酶和/或胸苷酸合成酶的合成化合物。用于癌症化疗的新型经典抗叶酸剂(叶酸结构类似物)包括曲美他嗪,培美曲塞和雷替曲塞,而非经典抗叶酸剂作为抗肿瘤和抗菌剂的功能也得到了研究。培美曲塞是一种多靶点抗叶酸剂,除胸苷酸合酶和二氢叶酸还原酶外,还可阻断几种叶酸循环酶。
由于叶酸代谢是癌细胞和正常细胞的基础,因此叶酸耗竭及其导致的DNA合成和DNA甲基化的减少必然对恶性细胞和正常细胞都有毒性。使用健康细胞进行的研究表明,缺乏叶酸会导致DNA损伤,包括染色体断裂和序列编码错误,可能是由于胸苷水平不足。叶酸耗竭也可能导致S-腺苷甲硫氨酸水平降低,导致DNA低甲基化。一项体内研究发现,大鼠叶酸缺乏与DNA链断裂和p53抑癌基因特定序列的低甲基化有关。1研究人员选择研究p53可能与膳食叶酸缺乏有关的变化,因为该基因在30-50%的常见人类癌症中发生了突变。
矛盾的是,抑制叶酸代谢已被用作成功消除恶性细胞的机制,但正常细胞中叶酸水平不足与DNA损伤和DNA甲基化条件改变有关,而这些条件与恶性转化有关。因此,干扰或预防叶酸代谢可能既是恶性肿瘤的原因,也是诱导恶性细胞凋亡或坏死的手段。叶酸代谢循环的复杂性及其在构建和修饰细胞基本生物分子中的应用使得这种悖论得以存在。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?