使用 PureProteome™ 磁珠和 KingFisher® 磁珠纯化仪自动化纯化 IgG(免疫球蛋白 G)
简介
随着研究、诊断和治疗环境中对抗原特异性免疫球蛋白的需求激增,对高重现性、高批次间一致性抗体和抗体试剂需求也随之水涨船高。为满足高通量、低人为差异的要求,许多实验室转用自动化系统,利用 Protein A 或 Protein G 磁珠进行抗体纯化。
传统纯化方法使用琼脂糖(大批量模式)或填料离心柱,这需要繁琐的离心步骤;而自动化磁珠纯化仪能够稳定地一次处理多份样品,同时减少实操时间。此外,此工艺具有高度可重现性,并消除了样品之间的交叉污染风险。
液体处理和磁珠处理机械臂是自动化磁珠分离方案常用的两种系统类型。在液体处理机械臂中,通过集成外部 96 孔微量滴定磁力架从液体中分离磁珠,实现磁力分离。也可通过 KingFisher® 磁珠纯化仪等磁珠处理机械臂,使用带有一次性塑料吸头的磁力棒在不同溶液间转移磁珠。
PureProteome™ Protein A 和 Protein G 磁珠 可从血清、血浆或细胞培养上清液样品等复杂混合物中快速、可重现地纯化免疫球蛋白。纯化 IgG 时 ,须将样品与 PureProteome™ Protein G 磁珠混合一小段时间,等待磁珠与免疫球蛋白结合。然后通过磁力分离法分离磁珠,经过几遍洗涤去除未结合的蛋白质。最后,将结合的蛋白质洗脱至高纯度,进一步用于下游应用。我们使用 KingFisher® Duo 磁珠纯化仪评估了 PureProteome™ Protein G 磁珠在 IgG 全自动纯化过程的效率。为获得理想的结果,我们针对PureProteome™ Protein G 磁珠的使用要求,优化混合速度、磁珠收集时间以及结合和洗涤步骤时长等参数。
材料和方法
抗体纯化─标准手动实验方案
使用 100 μL 悬浮 PureProteome™ Protein G 磁珠浆液(货号:10000),在 1.5 mL 微量离心管(一式六份)中纯化兔血清中的 IgG。使用含有 0.01% Tween® 20 去垢剂的磷酸盐缓冲盐水 (PBS)(货号:655205)作为结合/洗涤缓冲液。使用 PureProteome™ 磁力架(货号LSKMAGS08),用 500 μL 结合缓冲液剧烈涡旋洗涤磁珠 10 秒,将磁珠收集在磁力架上并用移液管去除缓冲液。用结合缓冲液将兔血清 (25 μL) 稀释至 200 μL,然后加入磁珠。将混合物在室温下孵育 30 分钟,全程不断搅拌混合。丢弃未结合的组分,并按前文所述用 PureProteome™ 磁力架和 500 μL 洗涤缓冲液洗涤 3 遍以捕获磁珠。最后,向磁珠中加入 100 μL 0.2 M 甘氨酸 HCl(pH 2.5)并在室温下混合 1-2 分钟洗脱 IgG。按类似的方式再加入 50 μL 洗脱液洗脱,以实现最大产量。用 PureProteome™ 磁力架将两种洗脱物收集到同一微量离心管中,保存供后续分析。
抗体纯化─KingFisher® Duo 实验方案
首先,将所有试剂和样品加入 KingFisher® Duo 平板(Microtiter Deepwell 96 孔板和洗脱联板),并根据板布局和优化条件构建King-Fisher® Duo 系统(Thermo Fisher)方案(PureProteome™ 磁珠混合和收集参数),如表 1 所示。与手动方案类似,取 100 μL 悬浮 PureProteome™ Protein G 磁珠浆液使用 KingFisher® Duo 系统进行 IgG 纯化。用含有 0.01% Tween® 20 去垢剂的 PBS 作为结合/洗涤缓冲液,取 25 μL 兔血清(在结合缓冲液中稀释至 200 μL 总体积)加入 Microtiter Deepwell 96 孔板的 D 行,中等混合速度下进行结合步骤 30 分钟。在洗脱联板中使用 0.2 M 甘氨酸 HCl(pH 2.5)进行洗脱,以更好地回收样品。执行方案并将平板上样到 KingFisher® Duo 系统。运行完成后,取出板并收集纯化样品等待进一步分析。
Bradford 测定法蛋白定量
取 10μL IgG 标准品和样品加入微量滴定板,然后加入 300 μL Coomassie™ 试剂。在摇床上短暂混合反应物,通过检测 595 nm 处的吸光度分析样品,并参照 IgG 标准曲线确定浓度。
十二烷基硫酸钠聚丙烯酰胺凝胶电泳 (SDS-PAGE)
在 70 °C 下还原并变性纯化样品(10 μL 洗脱组分)和对照兔血清(5 μL 起始材料) 10 分钟,然后上样到 1 mm 厚的 4–12% 梯度 NuPAGE® Bis-Tris 凝胶(Life Technologies)上。200 V 下分离蛋白 35 分钟。 电泳后,从凝胶盒中取出凝胶,用 Milli-Q® 纯水短暂漂洗洗涤 3 次,并根据微波实验方案用 SimplyBlue™ SafeStain 染色剂染色。然后在 Milli-Q® 纯水中洗涤染色凝胶 10 分钟并成像。
结果
蛋白产量
通过 Bradford 测定法分析通过自动和手动实验方案获得的纯化样品,确定蛋白质产量。结果表明,使用 KingFisher® 系统洗脱的 IgG 总量与手动工艺相近(表 2)。
SDS-PAGE 和 Coomassie® 染色
还可通过 SDS-PAGE 分析洗脱组分,确定洗脱特异性和重现性。染色凝胶目视检查(图 1)显示纯度和产量很高,表明 PureProteome™ Protein G 磁珠可供 KingFisher® 磁珠纯化仪获取可重现的批量 IgG。
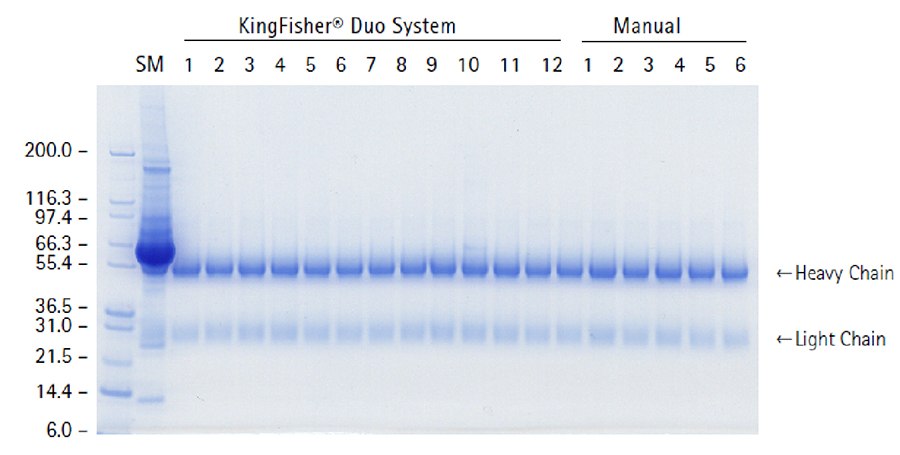
图 1.SDS-PAGE凝胶:使用 PureProteome™ Protein G 磁珠从兔血清中纯化 IgG。使用 0.2 M 甘氨酸 HCl pH 2.5 洗脱抗体。SDS-PAGE 分离样品,并通过 Coomassie® 染色可视化条带(最左侧泳道对应分子量标准;SM = 起始材料;其余泳道是 KingFisher® Duo 洗脱组分和手动测试洗脱组分)。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?