地高辛 (DIG) 标记方法
- 地高辛 (DIG) 标记和抗 DIG 抗体
- 通过 PCR 进行 DIG DNA 标记
- DIG随机引物 DNA 标记
- 原位探针dsDNA切口平移标记
- RNA探针转录标记
- DIG寡核苷酸标5'端、3'端和3’尾端标记
- 通过直接检测程序估算探针产量
- DIG相关下载和资源
地高辛 (DIG) 标记和抗 DIG 抗体
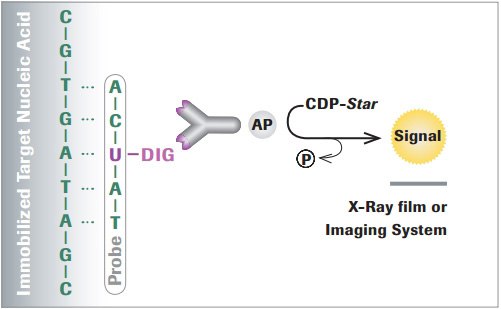
DIG系统是在多种应用中标记和检测核酸的首选非放射性技术。该系统基于从洋地黄植物(紫毛地黄和狭叶毛地黄)中分离的类固醇。这些植物是地高辛的唯一天然来源,因此抗DIG抗体不与其他生物材料结合,可确保特异性标记。由于具有很高的特异性,DIG系统比放射性标记所需的材料更少,非常适合进行核酸杂交分析。固定的核酸与DIG标记探针杂交,然后使用高亲和力的抗地高辛配基进行检测,并与碱性磷酸酶(AP)、辣根过氧化物酶(HRP),荧光素或罗丹明偶联以进行比色以及化学发光或荧光检测 。

图 1.使用化学发光底物检测DIG标记核酸的实例。
通过 PCR 进行 DIG DNA 标记
当仅能获得有限量模板时,当模板仅仅部分纯化时,或者当模板非常短时,PCR标记是制备DIG标记探针的优选方法。它比其他方法需要更少的优化,且标记探针产量高。在PCR标记过程中,热稳定聚合酶会在扩增模板DNA特定区域时结合DIGdUTP。其生成的是高度标记、非常特异、且非常敏感的杂交探针。
反应原理
在标准PCR反应期间,将地高辛-11-dUTP掺入新合成的DNA中。唯一的先决条件是需要靶序列的一些序列信息,以便合成合适的引物。非放射性DIG系列使用地高辛(一种类固醇半抗原)标记DNA、RNA或寡核苷酸以用于杂交,并随后进行染色或发光检测。地高辛通过碱不稳定的酯键与dUTP偶联。标记后的dUTP可以很容易地通过用DNA聚合酶实现的酶促核酸合成加以掺入。非放射性标记与PCR的组合,是用于分析PCR产物以及从少量相应靶序列制备标记探针的有力工具。
PCR DIG DNA标记的特点和优势
PCR条件
- 在尝试掺入DIG之前,在不存在DIGdUTP的情况下,根据每个模板和引物组,优化PCR扩增参数(循环条件、模板浓度、引物序列、和引物浓度)。
模板
- 为获得理想结果,请使用克隆插入片段作为模板。基因组DNA可能不便使用。
- 模板浓度决定特定探针生成的成功与否。
标记
PCR DIG探针合成试剂盒比大多数标记方法需要更少的优化,因为它包含扩展高保真酶混合物。这种酶混合物:
- 可以有效地使用富含GC区域作为模板
- 对于大多数模板,不需要优化MgCl2浓度,也就是说,大多数标记反应都适合1.5 mM MgCl2标准浓度
DIG随机引物 DNA 标记
“随机引发” DNA标记方法基于所有可能的六核苷酸混合物与DNA模板的杂交。所有序列组合均在六核苷酸引物混合物中呈现,导致引物以统计学方式与模板DNA结合。因此,保证了整个模板DNA长度相等程度的标记。互补链使用标记级Klenow酶从随机六核苷酸引物的3´OH末端合成。反应物中存在的修饰脱氧核糖核苷三磷酸酯([32P]-、[35S]-、[3H]-、[125I]-、地高辛或生物素标记)掺入新合成的互补DNA链中。
这些标记探针尤其适用于检测基因组Southern印迹上的单拷贝基因、筛选重组文库、点/槽印迹和Northern印迹。由于每种引物各有不同的六碱基序列,因此标记探针产物实际上是可变长度的片段的集合。因此,标记探针在凝胶上将显示为弥散型条带,而不是特异的条带。标记探针的大小分布取决于原始模板的长度。
反应原理
在随机引物标记中,Klenow酶在六聚体引物和碱不稳定的DIG-11-dUTP存在下拷贝DNA模板。平均而言,酶在每个20-25个核苷酸的区段中插入一个DIG基团。得到的标记产物是均一标记的敏感的杂交探针(可检测小至0.10-0.03 pg的靶DNA)。
原位探针dsDNA切口平移标记
切口平移法机制:在Mg2 +存在条件下,DNase I可在低酶浓度下将随机分布的切口引入DNA。大肠杆菌DNA聚合酶I使用切口3´-OH末端作为引物,以5´-3´方向合成与完整链互补的DNA。DNA聚合酶I的5´-3´核酸外切活性同时去除了合成方向上的核苷酸。聚合酶活性依次用同位素标记或半抗原标记的脱氧核糖核苷三磷酸,替代去除的核苷酸。因此,在低温(+15°C)下,反应中未标记的DNA被新合成的标记DNA取代。对于原位杂交方法,所获得的标记片段的长度应该约为200-500个碱基。
RNA探针转录标记
对某些应用,DIG标记的RNA是比DIG标记的DNA更有效的杂交探针。例如,DIG标记的RNA探针可以检测纳克量级的总RNA中的稀有mRNA。这些标记RNA探针通过DNA模板的体外转录产生。在RNA转录方法中,DNA被克隆到不同RNA聚合酶(例如T7、SP6或T3 RNA聚合酶)的启动子之间的转录载体的多克隆位点。然后,通过在独特位点(插入片段附近)切割载体使模板线性化。在核糖核苷酸的混合物(含DIG-UTP)存在下,RNA聚合酶把插入的DNA转录成反义RNA拷贝。在反应过程中,DNA可以被转录多次(高达上百倍),以产生大量全长DIG标记的RNA拷贝(在标准反应中,从1 μg DNA可生成10-20 μg RNA)。DIG在大约每隔25-30个核苷酸的位置掺入到RNA中。
反应原理
把待转录的DNA模板克隆到合适的转录载体的多接头位点,转录载体含有SP6和/或T3和T7 RNA聚合酶的启动子。当合适的位点线性化之后,在DIG-11-UTP存在下转录RNA。在标准条件下,从1 μg模板约转录10 μg全长DIG标记的RNA。
关于RNA探针标记的重要提示
RNases
RNases 无处不在,无需任何辅助因子提供活性。如果希望标记成功,须采取所有可能的预防措施防止RNase污染。例如:
- 尽可能使用一次性塑料器皿、烘箱消毒过的玻璃器皿、或者用RNase ZAP或类似试剂消毒过的塑料器皿。
- 用经过焦碳酸二乙酯(DEPC)或二甲基二碳酸酯(DMDC)处理的水制备所有溶液,将溶液高压灭菌。
- 整个操作过程都佩戴手套。
- 标记效率很大程度上取决于DNA模板的纯度。模板应该高度纯化。
- 最终模板必须线性化,用苯酚/氯仿萃取,并用乙醇沉淀。
模板序列
- DNA模板中的某些引物和/或多接头区域与核糖体28s和18s RNA序列部分同源。因此,标记探针可能在含有这些显著RNA的样品中产生特异的、但不需要的信号。为了最大限度地减少这种影响,应尽可能多地从模板中去除多接头序列。
- 如果使用PCR制作DNA模板,扩展高保真反应的产物中会含有一些具有单个3' A突出端的片段。这种突出端可在转录标记反应中产生被包裹的产物。
模板长度
- 最佳模板长度约为1 kb
- 最小长度应至少为200 bp
探针的储存
- 为保持长期稳定,应将RNA探针等分后储存于-20°C或-70°C下
- DIG标记的RNA探针在乙醇中保存在-20°C或-70°C下,可至少保持稳定1年
探针灵敏度
- 为了快速确定DIG标记的反义RNA探针的灵敏度,需要在体外转录中制备相应的正义RNA(未标记)。然后,用不同浓度的纯化的正义转录物作为北方印迹的靶标。根据印迹结果,即可容易地确定可以用标记探针(反义转录物)检测的最低靶标量(正义转录物)。
DIG寡核苷酸标5'端、3'端和3’尾端标记
对某些应用,例如原位杂交,DIG标记的合成寡核苷酸是最佳的杂交探针。除了原位杂交之外,DIG标记的寡核苷酸可用作以下应用中的杂交探针,包括点/槽印迹、文库筛选、Southern印迹上的重复基因序列检测、在Northern印迹上的富集mRNA检测
有几种方法可用于寡核苷酸的DIG标记,这些方法总结如下。
用DIG-NHS-酯标记寡核苷酸5'末端
用DIG-ddUTP标记寡核苷酸3'末端
添加DIGdUTP和dATP的3'尾(约40-50个残基)
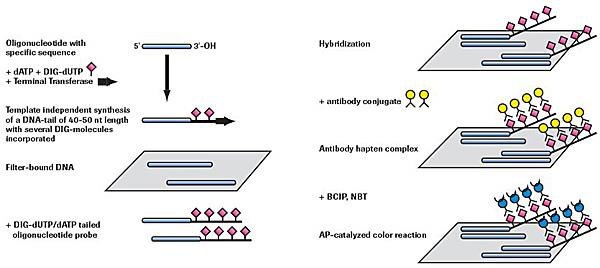
图 2.非放射性寡核苷酸加尾和检测。
通过直接检测程序估算探针产量
为了在杂交中添加正确数量的探针,必须首先确定标记反应中产生的DIG标记探针的量。本文给出的直接检测程序把从标记探针制备的DIG标记物进行连续稀释,然后与已知浓度的DIG标记的对照核酸进行比较。
注意:如果是通过PCR标记DNA探针,则无需执行直接检测来估算产量。
对于PCR标记的探针,使用凝胶电泳评估法。
直接检测法包括以下步骤:
- 制备标记探针的连续稀释液,并在尼龙膜上点样(所需时间:15分钟)
- 用化学发光法检测点样中的DIG,所需时间为2-2.5小时。
DIG相关下载和资源
需要相关帮助?查看我们的DIG 产品选择指南。
更多信息请查看以下手册:
详细技术信息请见DIG手册:
通过我们的技术要点了解如何处理DIG系统:
仅用于生命科学研究。不可用于诊断流程。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?