细胞转染简介
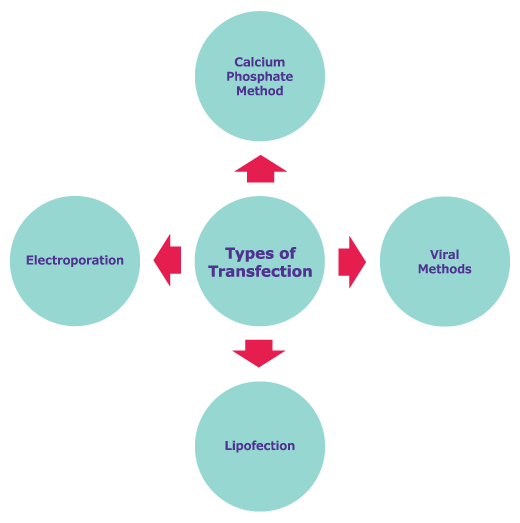
转染类型
目前存在多种转染方法,包括物理、化学和生物技术方法。这些技术通常涉及利用瞬时或稳定转染方法将核酸掺入细胞中。
瞬时转染技术涉及将DNA引入细胞,但在该方法中,DNA不与细胞染色体整合。该技术具有较高的转染效率,并且可在1-4天后分析基因转录。对于哺乳动物细胞培养物的大规模瞬时基因表达(TGE),可以使用转染载体,例如聚乙烯亚胺(PEI)和磷酸钙(CaPi)。此外,目前还开发出了在没有血清的情况下使用中国仓鼠卵巢(CHO)细胞的大规模TGE方法1。
稳定转染技术涉及将转染的DNA整合到细胞染色体中或形成附加体。随后可以使用可选择标记鉴定稳定转染的细胞,这些标记包括二氢叶酸还原酶(DHFR)、潮霉素B磷酸转移酶(HPH)和腺苷脱氨酶(ADA)等。
部分常用的转染技术包括磷酸钙沉淀、脂质转染、电穿孔和病毒递送。另外,这些方法可用于共转染。这些技术涉及将两种不同的核酸同时输送到同一细胞中,并且通常用于实现稳定转染。转染方法已经发展出许多新方法,例如使用高速微粒输送细胞核酸的Biolistic输送系统,以及促进siRNA分子全身输送的体内转染方案。
磷酸钙转染
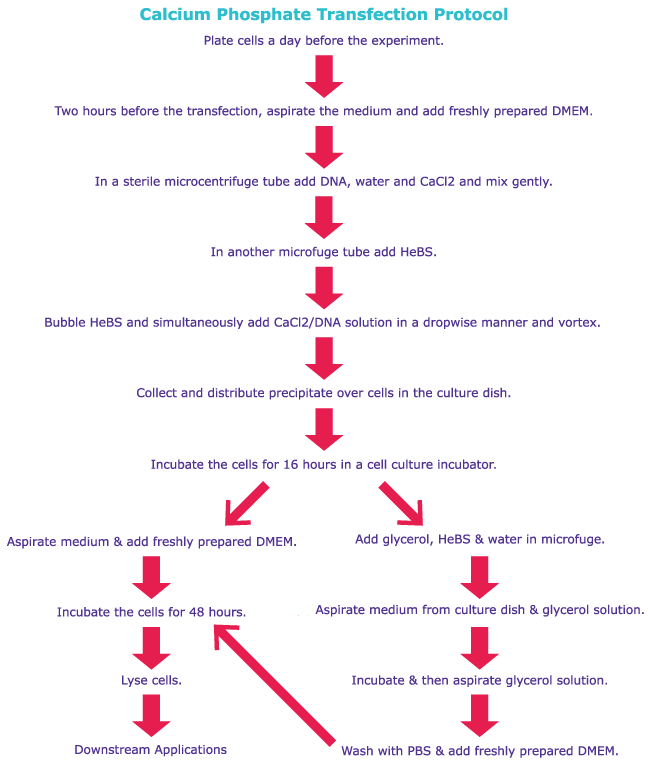
磷酸钙转染技术涉及DNA和磷酸钙的沉淀。通过将含有磷酸钠的HEPES缓冲盐水溶液与氯化钙溶液和DNA混合来促进沉淀2。甘油休克通常用来增强某些细胞中的DNA摄取。
虽然这种技术具有成本效益,可用于多种细胞的瞬时或稳定转染,但pH值相对较小的变化(±0.1)就会影响转化效率。此外,必须保持试剂均质以实现可重现的分析结果。但这种转染方法在RPMI或其他具有高磷酸盐浓度的培养基中不起作用。
脂质体介导转染
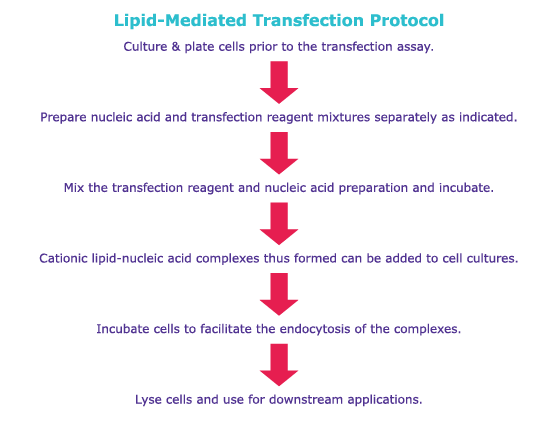
脂质体介导转染(脂质转染)技术涉及使用能够形成脂质体的阳离子脂质或者非脂质聚合物。例如,脂质转染试剂可能含有DOTMA(N-[1-(2,3,-二油烯氧基)丙基]-N,N,N-三甲基铵氯化物)和X-tremeGENE™转染试剂,适于将多种DNA、小RNA和CRISPR/Cas9成分转染进多种细胞系中。经过相应修改,脂质转染也可以用于具有成本效益的高通量系统,但这种转染技术通常是细胞类型特异性的。
电穿孔转染
该技术涉及将细胞膜暴露于高强度电脉冲,这导致细胞的某些区域暂时失去稳定性。在这种瞬间失稳期间,细胞膜变得高度可渗透并允许各种外源分子进入,包括DNA4。
电穿孔是一种简单的非化学技术,可以在各种细胞类型中产生高转化效率。尽管该技术不改变靶细胞形态和功能,但如果不在最佳条件下进行转染,该方法可导致细胞死亡。
病毒转染
该方法涉及使用病毒载体将核酸输送到细胞中。诸如慢病毒、腺病毒和肿瘤逆转录病毒载体等病毒递送系统,即使在复杂细胞中,也可转染核酸。
尽管病毒递送方法非常有效,但可能相当耗费人力。此外,大多数病毒需要控制和仔细监测生物安全水平。在进行病毒转染之前,考虑几种限制因素也很重要,例如病毒载体的裂解性质、细胞系包装和宿主细胞特异性。
选择转染试剂和实验方案
随着转染实验方案的发展和转染分析方法的日益简化,为了达到最佳转染效率,选择合适的转染试剂十分必要。
在考虑合适的转染试剂时,重要的是鉴定测定的细胞类型和培养条件。稀有细胞培养物、神经元和原代细胞通常较难转染,因此需要能够促进转染的试剂,对这种难以转染的细胞更是如此。
此外,在选择合适的转染剂之前,还应考虑试剂水平和细胞毒性参数。对于所需的细胞类型,理想的试剂应具有低细胞毒性和高转染效率。
通用实验方案
下面给出了磷酸钙转染和脂质转染技术的通用实验方案,可供用户比较。有关详细的操作步骤,请参阅产品具体的实验方案。
产品列表
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?