细胞培养表面的演变
简介
在过去的100年里,细胞培养从实验室的一个兴趣发展成为一个有价值的应用广泛的研究和生物生产工具。在此期间,随着研究目的的改变,用于细胞生长的表面也在变化。从Ross Harrison在1907年开始青蛙组织培养后,直到20世纪40年代,大多数细胞都是作为外植体组织在悬滴培养物或PYREX®玻璃烧瓶和培养皿底部的血浆凝块上生长的。在20世纪50年代中期,首次使用胰蛋白酶,成功将小鼠L细胞(1943)和人HeLa细胞(1951)这两种细胞系传代培养成单细胞悬浮液,从而导致大多数细胞在玻璃烧瓶或培养皿上作为单层细胞培养物生长。1954年,多伦多Connaught医学研究实验室的研究人员在5L的 PYREX Povitsky烧瓶中培养猴肾细胞,为Jonas Salk研制的脊髓灰质炎病毒疫苗生产病毒。这也是细胞培养在商业化产品生产中的首次应用。这些突破,以及现代合成细胞培养基的发展,比如M199(1950,用于脊髓灰质炎疫苗项目)和Eagle的广泛使用的最低必须培养基(1959),促进了细胞培养作为研究和生产工具的快速发展。
然而,许多细胞,尤其是原代细胞培养物,很难被附着到玻璃上,因此,1956年,George Gey将鼠尾胶原蛋白涂覆在玻璃表面以促进细胞的附着和生长。此外,玻璃培养容器需要非常仔细的清洁以保证溶剂残留不会干扰细胞进程。因此,研究人员开始尝试使用一次性塑料培养容器,比如第一个微孔板。到了20世纪60年代,塑料烧瓶、培养皿和96孔板已经成功商用。这些容器大部分是使用聚苯乙烯制造的,这是一种长碳链聚合物,每隔一个碳连接一个苯环。选择聚苯乙烯是因为它具有出色的透光性,易于模塑并可以通过辐射消毒。但是,聚苯乙烯也有一个明显的缺陷——它是一种非常疏水的(不可润湿)聚合物,从而细胞很难附着其上。为了使得细胞可以良好地附着,疏水的聚苯乙烯表面必须被改造为更亲水的表面。在含有血清的培养基中发现的细胞附着蛋白(玻连蛋白和纤连蛋白)可被黏附在容器底部并扩散,从而提供了更适于细胞附着的表面。对于刚刚模塑过的聚苯乙烯表面,可以使用大气条件下的电晕放电或者真空条件下的气体等离子方法进行处理。这些处理都会产生高能氧离子,氧化并结合到表面的聚苯乙烯链上(见图1),这样一旦添加了培养基,表面就会变成亲水的和带负电荷的。1-4到了20世纪70年代中期,大部分研究者都使用处理后的聚苯乙烯容器培养细胞培养物,而不是玻璃容器。
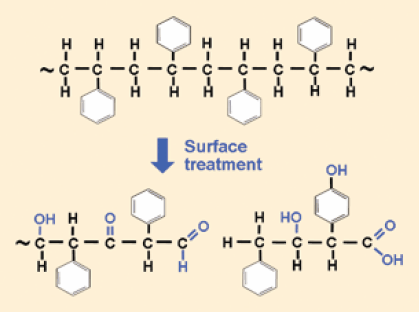
图 1.聚苯乙烯可以通过添加不同的化学基团、断裂碳链主链或打开苯环(未显示)等方法来进行表面改性。
到了20世纪70年代末,研究人员发现即使是处理过的聚苯乙烯也有其局限性,尤其是在在无血清培养基中培养细胞以及保持初代培养物和细胞系的细胞分化功能方面。同时,研究人员开始研究基底膜提取物和纯化的附着蛋白,以更好地了解它们在细胞附着、迁移和功能中的作用。5作为研究结果,一些细胞研究者开始在培养容器表面进行涂覆以增强细胞的附着和性能。他们单独使用或混合使用了多种生物材料,包括细胞外基质、附着和黏着蛋白(如胶原蛋白、层粘连蛋白和纤连蛋白)和黏多糖(如硫酸肝素、透明质酸盐和硫酸软骨素)。聚-D-赖氨酸(PDL)等基础合成聚合物也被用作涂层以在聚苯乙烯上产生一个正电荷,对于某些种类的细胞,这可以增强细胞的附着、生长和分化,尤其是在无血清或低血清的条件下。PDL涂层通常可以提高原代神经元、胶质细胞、神经母细胞瘤和一系列转染细胞系的附着和生长。在细胞微孔板分析的反应过程中,可使用PDL涂层以帮助细胞附着在孔的底部。
Corning® CellBIND®表面
由于生物涂层价格昂贵、各批次间差异显著并且有传播危险生物制剂的潜在风险,2003年,Corning® CellBIND®培养表面被开发以增强细胞在困难条件下的附着性,例如使细胞适应无血清培养基或者恢复冷冻细胞。Corning的科学家开发了一项专利处理技术(美国 专利6,617,152),使用高能微波等离子体在聚苯乙烯表面引入更多氧,从而使得其更加亲水(可润湿),同时,与传统的等离子体或电晕放电技术处理过的表面相比,该表面的稳定性更好。
与生物涂层不同,Corning® CellBIND®表面不需要特殊的处理或者保存,并且,由于聚苯乙烯是被处理过,而不是被涂覆,该表面更一致和稳定。与传统的经过处理的聚苯乙烯表面相比,Corning® CellBIND®表面使得难以附着的细胞系,尤其是转染细胞,可以更快速更稳定均匀地附着其上。6它还可以减少未成熟细胞从培养物上的脱离,尤其是在滚瓶培养和细胞分析测定中。这些增强的细胞性能使得生物技术公司可以使用Corning滚瓶和Corning® CellBIND®表面来生产FDA认证的蛋白治疗制剂和疫苗。
在从冷冻培养物中恢复细胞时,细胞的良好的附着性显得尤为重要,因为附着不好会导致未附着细胞的凋亡和坏死,从而造成培养物恢复缓慢以及研究时间的减少。这一点已使用LNCaP细胞论证(见图2)——LNCaP细胞是一种前列腺癌细胞系,由于其附着性差,常常难以培养。通过提高解冻后细胞的附着性,Corning® CellBIND®表面可以大大改善液氮保存后LNCaP细胞的附着性和产量。7
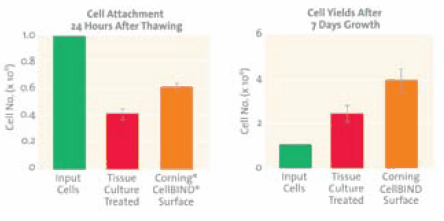
图 2.左:解冻后24小时,Corning CellBIND表面LNCaP细胞的附着比在标准细胞培养表面高49%。右:7天后LNCaP细胞产量比标准细胞培养表面高69%。添加细胞为小管中细胞数。数据为平均数±3次重复实验得到的标准误差。
Ultra-Web®合成表面
传统的聚苯乙烯和玻璃表面是2-D平面的,即使以生物材料作为涂层,在促进通常在体内的3-D环境中进行的体外细胞功能比如转运和分化时,也无法令人满意。为了突破这些限制,Corning和 Donaldson Co.以及Surmodics, Inc.合作,在近期开发了一种新的 Ultra-Web®合成纳米纤维表面,为细胞提供一个更接近体内3-D环境的纤维状地貌,从而提高它们的性能和功能(图3)。与生物涂层不同,这些表面更加稳定,批次间更均一,且不含动物成分。它们还可以提供一个理想的基质,使研究人员可以在类似体内培养微环境中,将细胞附着性和生长因素联系起来进行更多研究。8
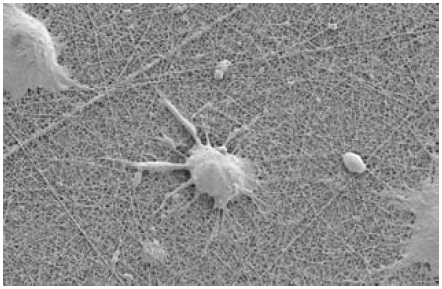
图 3.NG108神经元在Ultra-Web纳米纤维表面生长。该表面与胶原蛋白和其他ECM表面类似,但是是完全合成的。由于其孔隙小,细胞是在其表面上生长而不是其中。
Ultra-Web®表面已被成功用于多种细胞的生长中,例如肝细胞、肾细胞、神经元细胞和干细胞。8-10这种新型的合成表面已被用于多种基于细胞的测定中,包括基于细胞的发光-报告基因和FLIPR钙通量测定。因为细胞生长在Ultra-Web表面上,被染色后易于观察(图4),并且可用标准方法收集细胞。
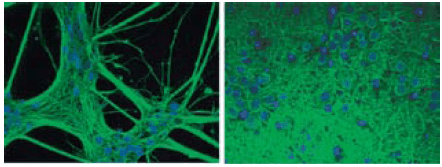
图 4.荧光共聚焦显微镜下的Ultra-Web表面。原代皮层神经元在Ultra-Web(左)和Ultra-Web多胺(右)表面培养了18天后,具有显著的3-D形态并保持了长期的神经元活力。使用Neurite Outgrowth HCS HitKit (Cellomics)对细胞进行染色,通过具有合适滤镜的倒置荧光显微镜观察(细胞体/神经突=绿色=b-III-微管蛋白,细胞核=蓝色=Hoechst染色)。
肝细胞培养物在Ultra-Web®表面上表现得极为出色。10相对于胶原蛋白I、IV、层粘连蛋白,人原代肝细胞在10天的培养后可得到相当数量的白蛋白,并且相较于未经涂覆的TCT微孔板,产量也有所增加(数据未列出)。在使用荧光测定时,与涂覆了胶原蛋白或胶原蛋白三明治的微孔板上培养的肝细胞相比,Ultra-Web表面上的肝细胞具有更强的细胞色素P450(CYP1A2)活性(图5)。使用50μM奥美拉唑诱导CYP1A2活性3天,并使用10μM荧光底物Ethoxyresorufin替换培养基,测定荧光值。在Ultra- Web®和Ultra-Web®多胺微孔板表面培养的肝细胞表现出初始P-450活性(蓝柱)和诱导CYP1A2活性(蓝线),后者几乎是胶原蛋白的两倍,与Matrigel类似。因此,合成Ultra-Web®表面提供一个在三维表面培养细胞的替代方法,并且没有任何生物涂层相关的问题。
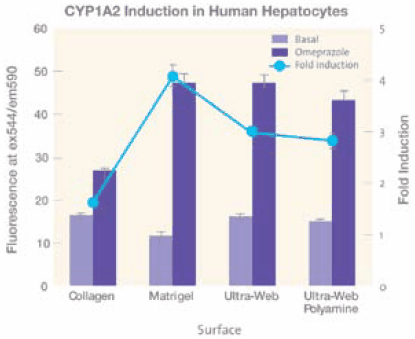
图 5.四种不同培养表面,胶原蛋白I和Matrigel™ (BD)、Ultra-Web和Ultra-Web多胺(Corning)表面对人原代肝细胞中CYP1A2活性的影响。Ultra-Web表面的表现优于胶原蛋白,与Matrigel相似但初始活性比后者高。
超低附着表面
有些时候,当研究人员培养细胞时,希望能够防止细胞附着到培养表面。此时,未处理的聚苯乙烯培养容器由于其疏水表现可以防止细胞附着,因而是首先被尝试的。但是,部分由于它们经过辐射消毒,这些未处理的容器仍然可以通过疏水相互作用连接附着蛋白以及某些种类的细胞。为了最大限度的降低细胞附着,Corning® 在20世纪90年代开发了超低附着表面涂层容器。该容器有一个非常亲水的中性电荷的水凝胶层,可以直接共价连接到聚苯乙烯表面并防止剥离。由于细胞附着蛋白和其他生物分子可以通过疏水相互作用或离子相互作用被动吸附到聚苯乙烯表面,因此通过这些作用力,水凝胶表面可以自然地抑制非特异性固定,从而抑制随后的细胞附着。该表面非常稳定,无毒性,且是生物惰性的。
由于这些特性,超低附着表面可以抑制巨噬细胞和中性粒细胞的附着和激活。11该表面也可以防止正常的贴壁依赖性细胞的附着,这通常会导致细胞凋亡。当在超低附着表面上进行培养时,贴壁依赖性细胞,例如肿瘤细胞或成人干细胞会作为静止悬浮培养物生长,通常会形成非附着的球体(图6)。这个能力使得超低附着表面容器成为从大脑和乳腺组织中分离原发性肿瘤和干细胞球体的理想选择,12-16并可以防止正常细胞过度生长而凋亡。超低附着表面也适用于从胚胎干细胞中培养非附着且易于收集的类胚体。17
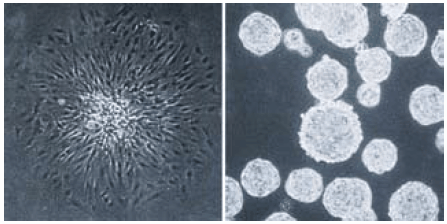
图 6.C6胶质瘤细胞的单细胞衍生菌落在一个经处理的标准组织培养容器中形成扁平的附着菌落(左图),但在Corning 超低附着表面则形成非附着的球体(右图)。
参考文献
如要继续阅读,请登录或创建帐户。
暂无帐户?