FITC标记多糖
FITC-葡聚糖
FITC-DEAE-葡聚糖 (FDD)
FITC-羧甲基 - 葡聚糖(FCM-葡聚糖)
FITC-聚蔗糖 (FITC-Ficoll®)
FITC-DEAE-聚蔗糖
FITC-CM-聚蔗糖 (FITC-CM-Ficoll®)
FITC-菊糖
荧光素透明质酸(FHA-Se)
TRITC标记多糖
TRITC-聚蔗糖 (TRITC-Ficoll®)
四甲基罗丹明透明质酸 (TR-HA)
参考文献
FITC-葡聚糖
荧光素异硫氰酸酯葡聚糖
化学名:
葡聚糖(3´,6´-二羟基-3-氧代螺(异苯并呋喃--1(3H),9´-[9H]占吨]-5(或6)-基)氨基硫代甲酸酯。
荧光素异硫氰酸酯 - 葡聚糖。
荧光素基硫代氨基甲酰基 - 葡聚糖。
CAS号:60842-46-8
结构
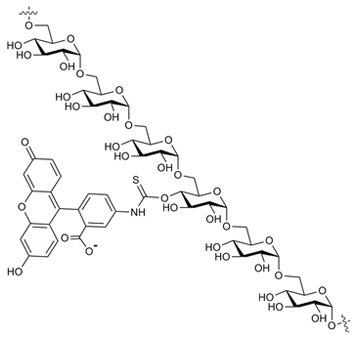
定义
Mw:重均分子量
Mn:数均分子量
DS:指多糖链中每个糖分子上取代分子的数目
性质
用荧光素对基于天然葡聚糖B512F所制备的特选葡聚糖组分进行标记,标记时采用稳定的硫代氨基甲酰键连接基团,标记步骤不会导致葡聚糖发生任何降解1。FITC-葡聚糖的DS范围为0.002-0.008,在该取代低水平范围内,反应对葡聚糖本身所带来的变化被尽可能地减少了,这一点对渗透性研究而言非常重要。
FITC-葡聚糖以黄色/橙色粉末形式供应,其在水中可以自由溶解;也可以黄色溶液形态的盐溶液形式供应。该产品也可溶于DMSO、甲酰胺等某些极性有机溶剂,但不溶于低级脂肪醇、丙酮、氯仿、二甲基甲酰胺。可以通过在剧烈搅拌下将粉末缓慢加入到温水(约60℃)中来实现高分子量组分的溶解。
分子量大于5 000道尔顿的葡聚糖分子在溶液中表现为柔性线团型(coil)链段。表1显示了不同分子量分子的尺寸。葡聚糖和FITC-葡聚糖呈现牛顿流动特性,即粘度与剪切速率无关。
光谱数据
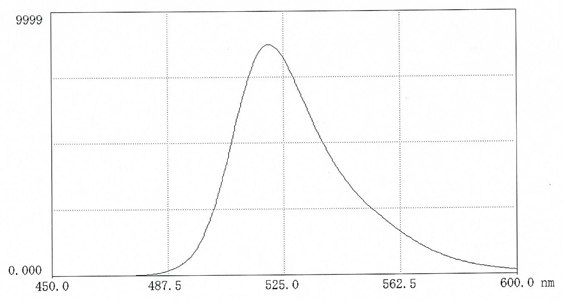
图 1.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,FITC-葡聚糖70的荧光扫描光谱。激发波长:495nm;发射波长:520 nm。

图 2.FITC-葡聚糖在pH 4-9范围内的荧光光谱(发射波长:520nm)
储存方法和稳定性
FITC-葡聚糖在体外和体内的稳定性都非常好——只有在高pH(> 9)和高温下,荧光素标记才有发生水解的风险。在37°C
的兔血浆、肌匀浆、肝匀浆和尿液研究中,FITC-葡聚糖的稳定期均不短于3天2。Mw无任何变化,荧光素组分释放不可见。 在6%的三氯乙酸中,FITC-葡聚糖可以在室温下稳定3天2。高压灭菌的FITC-葡聚糖70溶液可以在8至50℃下储存长达5个月。只有50℃样品中的游离氨基-荧光素含量出现略微增加(1%)。FITC-葡聚糖在pH4下保持稳定,但在pH9下,其荧光强度会在35℃、1个月内出现相当大的下降(24%)。数项研究3均证实了在实验(1-6天)期间FITC-葡聚糖的体内稳定性。
应用
FITC-葡聚糖主要用于细胞和组织中的渗透性和运输研究,但也可用于其他材料(过滤器、凝胶等)的渗透性研究。其有一点独特优势在于通过测量荧光,可以提供健康或患病组织的实时渗透性定量数据。活体荧光显微镜具有高灵敏度,即使组织液中的荧光浓度低至1μg/ ml也可以检测得到。人们已经开发了数个模型来方便实时研究4,5,FITC-葡聚糖也可用作细胞中的pH探针6,7。人们在偏振实验中还发现,激发态的寿命与共轭之前的寿命差不多。
FITC-葡聚糖在以下研究领域都已表现出了自身价值(我们从各个主题的众多文章中挑选出来的参考文献):
- 肠道组织渗透性研究8-10
- 脑和神经系统渗透性研究11-13
- 肿瘤组织渗透性研究14-16
- 眼内渗透性研究17-19
- 肾组织渗透性研究20
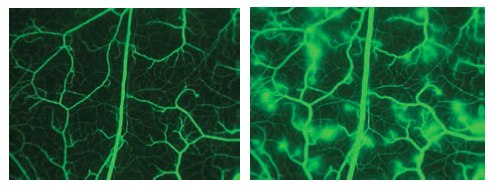
图 3.注入FITC-葡聚糖150后的颊囊图像。第二张图像显示了注入组胺后微血管出现的渗漏。 (已获得E.Svensjö许可)。
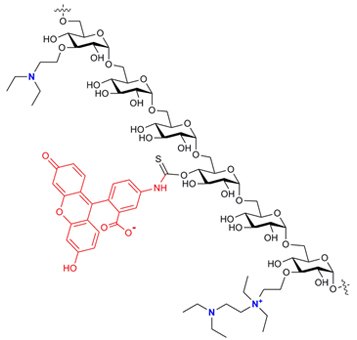
性质
FITC-DEAE-葡聚糖以易溶于水或电解质溶液的黄色粉末形式供应。其溶解速率取决于颗粒大小和结构,我们建议您在剧烈搅拌下缓慢加入粉末 – 如果产品分子量比较高,可以加热水。DS(FITC)在0.001-0.008之间,氮含量的范围是3-5% - 相当于每三个葡萄糖单位上约有一个DEAE取代基。我们通过合成在葡聚糖链中引入两种类型的DEAE-取代基(参见上面的结构图)。主要取代基是单一的叔胺基团,但其在高DS下会进一步发生反应,生成含有季胺以及叔胺的“串联”基团。
光谱数据
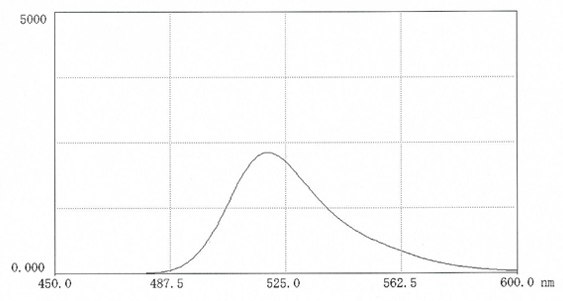
图4.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,FITC-DEAE-葡聚糖的荧光扫描光谱。激发波长:495nm;发射波长:520 nm。
储存方法和稳定性
将粉末遮光、储存在密封良好的容器中,可以在室温下稳定保存三年以上。FITC-DEAE-葡聚糖不应在pH> 8的溶液条件下长期保存。
应用
FITC-DEAE-葡聚糖具有母体DEAE-葡聚糖的众多特性,同时还具有荧光性以及可追踪性。 DEAE-葡聚糖的部分应用如下:
- 作为疫苗的佐剂
- 增强细胞对蛋白质和核酸的摄入量 - 转染技术和病毒感染性
- 稳定蛋白质(酶)
在利用穿孔素来研究有核细胞摄入带正电的分子的实验中,人们已经用到了FITC-DEAE-葡聚糖21。在吸收促进剂的某项研究中,人们比较了FITC-DEAE-葡聚糖、FITC-葡聚糖和FITC-葡聚糖硫酸盐通过鼻粘膜的渗透性22。
FITC-羧甲基 - 葡聚糖(FCM-葡聚糖)
化学名:
FITC羧甲基葡聚糖
荧光素-硫代氨基甲酰基-(O-羧甲基)-葡聚糖
CAS号:无
结构
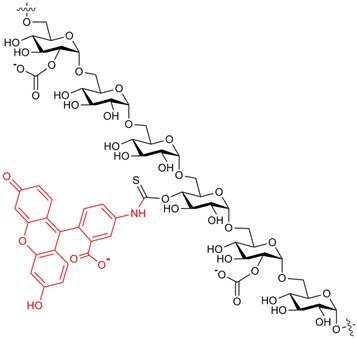
性质
FITC-CM-葡聚糖是通过特选葡聚糖部分与活化羧甲基衍生物在碱中发生反应而制得的,该过程在葡聚糖链上引入了O-羧甲基。羧基含量约为5%,相当于每5个葡萄糖单位上约有1个CM基团。此后,通过与异硫氰酸荧光素反应引入荧光素基团。 DS(FITC)介于0.003 - 0.008之间。 FITC-CM-葡聚糖以易溶于水或电解质溶液的黄色粉末形式供应。由于分子上带有负电荷羧基,产物具有明显的聚阴离子特征。FITC-CM-葡聚糖的溶液性质估计与CM-葡聚糖的溶液性质相当23-25。在中性溶液中,羧甲基取代基将相互排斥,导致葡聚糖线团型(coil)链段伸展。 FITC-CM-葡聚糖不溶于大多数有机溶剂,例如乙醇、甲醇、丙酮、氯仿、乙酸乙酯。
光谱数据
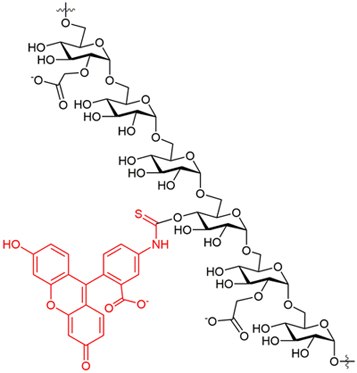
图5.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,FITC-CM-葡聚糖的荧光扫描光谱。激发波长:493nm;发射波长:519 nm。
储存方法和稳定性
相关的前瞻性稳定性研究已经证实:CM-葡聚糖的效力和纯度可以保存至少3年(该研究尚未发表),根据我们使用FITC-葡聚糖的经验,我们预测FITC-CM-葡聚糖具有类似的稳定性。我们建议将FITC-CM-葡聚糖储存在室温、遮光、密封容器中。
应用
CM-葡聚糖本身既具有生物相容性,被用作数种制药和诊断应用中的原材料。同样,FITC-CM-葡聚糖的毒性应该也很低。在葡聚糖链中插入羧基可以为将令人感兴趣的生物活性分子(药物、酶、诊断示踪剂)固定在葡聚糖上提供了进一步的机会。羧基部分可用于众多反应,例如酯化,以及与胺、UGI或Passerini反应。简单的离子结合反应也可以提供一系列结合了不同阳离子分子的衍生物26,27。羧基还会使得分子整体带上负电荷,对于获取细胞膜和组织的渗透性信息可能比较有价值28。FITC-CM-葡聚糖在药物递送系统研究中的应用已有相关报道29。
FITC-聚蔗糖(FITC-Ficoll®)
化学名:
聚蔗糖(3´,6´二羟基-3-氧代螺(异苯并呋喃-1(3H),9´-[9H]占吨]-5
(或6)-基)氨基硫代甲酸酯]
荧光素异硫氰酸酯 - 聚蔗糖
CAS号:无
结构:
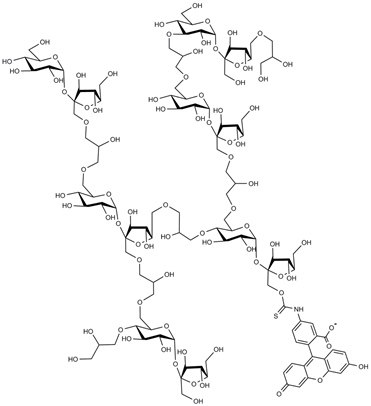
性质
采用类似于de Belder和Granath1所述的方法,用荧光素对聚蔗糖组分进行标记。通过稳定的硫代氨基甲酰基键连接基团与荧光素部分进行连接,标记步骤不会导致聚蔗糖发生任何降解。FITC-polysucroses的DS在0.001-0.008之间,在该低水平范围内,反应对聚蔗糖本身所带来的变化被尽可能地减少了。
FITC-聚蔗糖以黄色粉末形式供应,其在水或盐溶液中可以自由溶解,得到黄色溶液。该产品也可溶于DMSO、甲酰胺等某些极性有机溶剂,但不溶于低级脂肪醇、丙酮、氯仿、二甲基甲酰胺。
聚蔗糖分子在溶液中显示为球形分子,和结构预期结果一样。我们比较了葡聚糖和聚蔗糖组分的斯托克斯半径,该数据反映了分子灵活性之间的差异(表2)。该分子可视作介于坚硬的固体圆球和柔性线团型链端之间的中间体。因此,在比较具有相似分子量的聚蔗糖和葡聚糖组分时,聚蔗糖的分子尺寸会小一些。与具有相同浓度的蔗糖溶液相比,聚蔗糖溶液具有非常低的渗透压。例如,10%的聚蔗糖70溶液的渗透压为3mOs / kg,而10%蔗糖的渗透压为150。
目前还没有任何关于FITC-聚蔗糖详细毒性研究的报道。然而,在对实验动物静脉内施用12g / kg的聚蔗糖组分(100000-500000)后,未表现出任何毒性症状。聚蔗糖与细胞、病毒、微生物等之间具有良好的生物相容性,在细胞分离技术中已经应用了数十年。
光谱数据
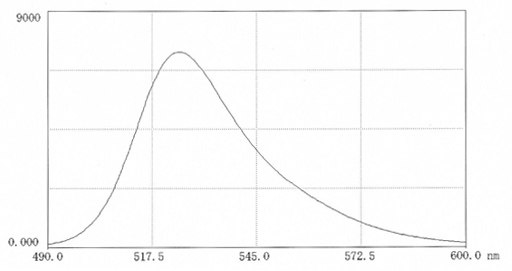
图 6.在0.025M硼酸盐pH9.0(9.9mg 盐溶于50ml缓冲液中)中,FITC-聚蔗糖70的荧光扫描光谱。激发波长:496nm;发射波长:525 nm。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。
储存方法和稳定性
在室温、气密容器中,FITC-聚蔗糖粉至少可以稳定储存6年。关于FITC-聚葡萄糖在溶液中的稳定性尚未有任何详细研究报道。然而,荧光素部分和聚蔗糖之间的硫代氨基甲酰基连接基团的稳定性类似于葡聚糖上连接基团(参见FITC-葡聚糖)的稳定性。FITC-葡聚糖在最高35℃的温度、pH 4下可以保持稳定长达1个月,但由于蔗糖中糖苷键具有不稳定性,所以不推荐将该方案用于聚蔗糖基产品。聚蔗糖本身可以在中性和弱碱性pH下高压灭菌。
应用
关于两种多糖(聚蔗糖(Ficoll®)和葡聚糖)在评估肾小球选择性中与肾小球蛋白对比的可用数据已有综述发表30。多分散多糖是测量肾小球选择渗透性的优良探针,其具有可重现性、可靠性和精确性。作者阐述了可能会对结果产生影响的各种特性,如分子大小、形状、电荷和灵活性,并评估它们在各种孔隙模型中的结果。静脉输注Ficoll肾小球渗透性的研究表明,其渗透性下限值在50Å左右,而葡聚糖预计值在60-70 Å,这一点可以由葡聚糖灵活性更大来解释。人们还通过研究FITC-聚蔗糖在缺乏内皮细胞膜的小鼠中的清除率来阐明大分子运输途径31。还使用FITC-聚蔗糖70和400(即FITC-菊糖)32来在不同的肾小球滤过率下研究肾小球滤过作用。
对葡聚糖和Ficoll肾小球滤过作用的研究显示,相比于葡聚糖,肾小球膜对Ficoll表现出更多的限制性屏障作用33。有趣的是,Ficoll筛分系数的值接近于不带电球状蛋白质的报道值。用FITC-聚蔗糖70/400监测手术和肌肉创伤后大鼠的肾小球筛分系数34。用FITC-聚蔗糖400(960μg)、FITC-聚蔗糖70(40μg)和FITC-菊糖(500μg)混合物作为初次推注给药给大鼠。使用FITC-聚蔗糖70/400在小窝蛋白-1敲除小鼠中研究肾小球渗透性35。
通过对大鼠输注FITC-聚蔗糖70和白蛋白来观察温度和氯化铵对清除率的影响。聚蔗糖的表现与葡聚糖不同,在20-70 Å范围内较低36,37。使用FITC-聚蔗糖70来评价糖尿病9周后天然白蛋白清除率的增加是由于电荷选择性降低还是大孔径比例的变化而导致的38。
FITC-DEAE-聚蔗糖
化学名:
FITC-(O-二乙基氨基乙基)-聚蔗糖
荧光素基-硫代氨基甲酰基-(O-二乙基氨基乙基)-聚蔗糖
CAS号:无
结构:
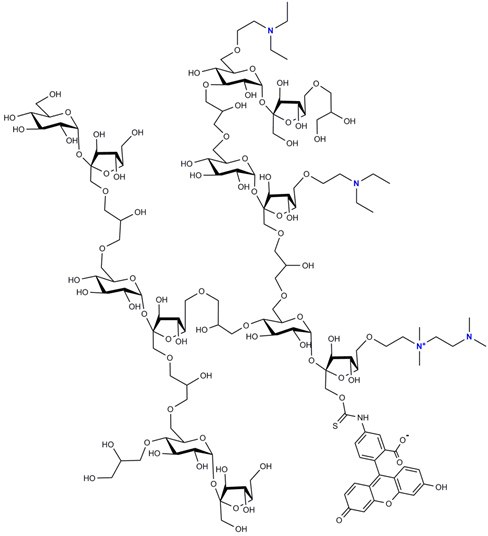
性质
FITC-DEAE-聚蔗糖以易溶于水或缓冲溶液的黄色粉末形式供应,大约每五个己糖基团上有一个DEAE基团。 FITC取代度在0.001至0.008之间。该产品具有聚阳离子特性。如以上结构表示中所描绘的一样,DEAE-取代基可以作为单个单元或作为“串联”单元存在,后者含有季铵结构。
光谱数据
激发最好在493nm下进行,而荧光测量在523nm处进行(图7)。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。
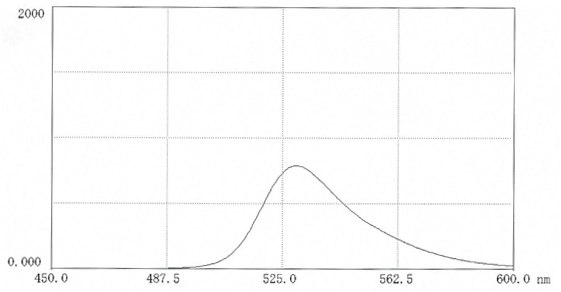
图 7.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,FITC-DEAE-聚蔗糖的荧光扫描光谱。激发波长:496nm;发射波长:530 nm。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。
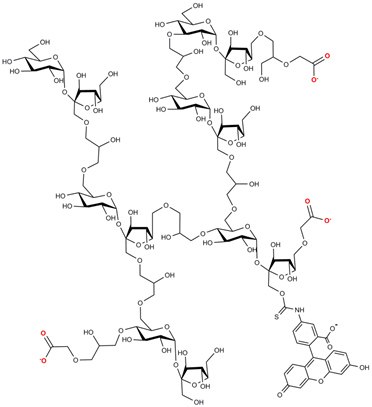
FITC-CM-聚蔗糖结构
光谱数据
激发最好在495nm下进行,而荧光测量在517nm处进行(图8)。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。CHECK
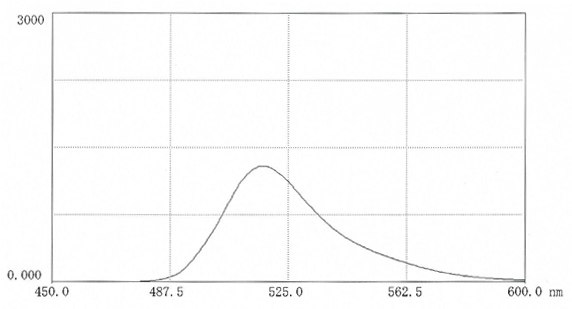
图 8.在0.025M硼酸盐pH9.0(11mg 盐溶于50ml缓冲液中)中,FITC-CM-聚蔗糖的荧光扫描光谱。激发波长:495nm;发射波长:517 nm。
储存方法和稳定性
FITC-CM-聚蔗糖以黄色干燥粉末形式供应,储存在黑暗、室温、密封良好的容器中。溶液可以保存在室温下,在pH6-7、黑暗、冷藏这一优选环境中可以保存数周。
应用
FITC-CM-聚蔗糖在阐明肾小球膜的性质方面发挥了重要作用,尽管膜上带负电荷,但阴离子Ficoll衍生物的选择渗透性还是要大于中性物质28。但是,后续使用FITC-CM-聚蔗糖所进行的研究反驳了这一发现39。对溶质电荷在肾小球膜筛分特性中的重要作用重新进行了研究40。
FITC-菊糖
化学名:
菊糖(3’,6’二羟基-3-氧代螺(异苯并呋喃-1(3H),9´-[9H]占吨]-5(或6)-基)氨基硫代甲酸酯]
荧光素异硫氰酸酯-菊糖
CAS号:无
结构:
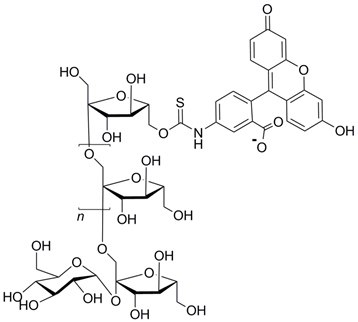
性质
对从大丽花块茎中提取的菊糖组分用类似于de Belder和Granath所述的方法用荧光素进行标记1。荧光素部分通过稳定的硫代氨基甲酰基键连接基团进行连接,标记步骤不会导致菊糖发生任何降解。 FITC-菊糖的DS在0.001-0.008之间,在该低水平范围内,反应对菊糖本身所带来的变化被尽可能地减少了。
FITC-菊糖以黄色粉末形式供应,可以溶于水或盐溶液,得到黄色溶液。稀释溶液(1-2%)在静置时保持透明,但更浓(> 10%)的溶液在静置时会形成沉淀,这是因为菊糖倾向于形成结晶聚集体。这些沉淀物将在加热时可以重新溶解。溶液在中性pH左右时可以接受高达80℃的温度。该产品也溶于DMSO、甲酰胺等某些极性有机溶剂,但不溶于低脂肪醇、丙酮、氯仿、二甲基甲酰胺、乙酸乙酯。
通过SEC测定的FITC-菊糖的Mw(Superose 6 + 12;葡聚糖校准)为 5000。Phelps40根据渗透压数据测定的菊糖组分Mw为5640。
光谱数据
激发最好在490nm下进行,而荧光测量在520nm处进行(图9)。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。荧光对pH的依赖关系如图10所示。
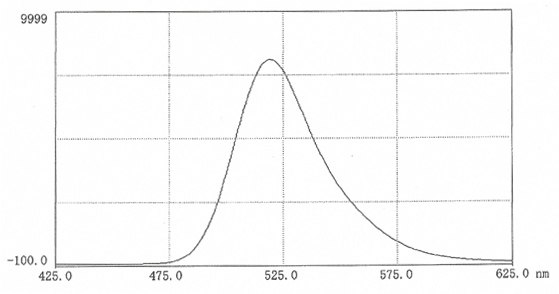
图 9.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,FITC-菊糖的荧光扫描光谱。激发波长:492nm;发射波长:519 nm。

储存方法和稳定性
荧光素部分和菊糖之间的硫代氨基甲酰基连接基团的稳定性和葡聚糖类似(关于FITC-葡聚糖稳定性的信息请参见数据文件)。目前尚未有任何关于FITC-菊糖稳定性的前瞻性研究,但回顾性研究表明FITC-菊糖粉末在室温、气密容器中至少可稳定存放6年。 FITC-菊糖溶液不应长期储存在低pH(<5)或高pH(> 9)下,特别是在高温环境下。
应用
已证明FITC-菊糖是研究实验动物肾小球滤过率的理想方法,其在过滤和肾通过期间可以保持稳定,不会结合血浆蛋白或透过肾细胞。荧光测量可以提供关于健康和患病组织的运输和渗透性的定量数据。这些研究可以通过活体荧光显微镜实时进行。该技术具有高灵敏度,可以检测到组织液中浓度低至1μg/ ml的物质。
在大鼠静脉内推注FITC-菊糖后,测定大鼠管状液与血浆浓度比值41。通过与51Cr-EDTA和[H3] - 菊糖进行比较,确定了该方法作为肾小球滤过作用量度方法的有效性。
Fleck于1999年对FITC-菊糖用于GFR研究进行了彻底研究42。通过尾静脉或颈静脉以每小时4ml / 100g体重的速率给予大鼠4mg / mL。Dunn及其同事43发现:小鼠肌酐清除率与FITC-菊粉清除率之间具有良好的相关性。其他研究中也使用FITC-菊糖测定了肾小球滤过作用44,45。
FITC-菊糖已被用于研究肠上皮细胞的渗透性46,47。
荧光素透明质酸 (FHA-Se)
化学名:
5-氨基荧光素标记的透明质酸盐
5-氨基荧光素标记的透明质酸
CAS号:无
结构:
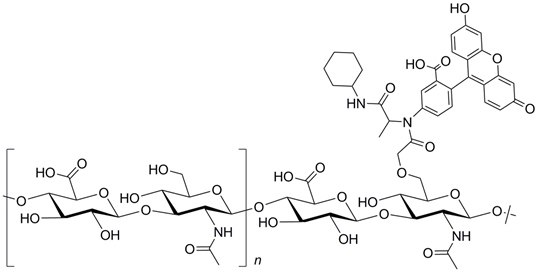
性质
自马链球菌中提取的透明质酸是一种由β(1-3)葡糖苷酸和β(1-4)氨基葡萄糖苷单元交替组成的多糖,对其用5-氨基-荧光素进行标记,得到黄色纤维状产品,其可以溶于水和电解质,不过,固体需要经过长时间的温和搅拌才能溶解(过夜)48。 取代度在0.001到0.008之间。用GPC系统测定的分子量(用葡聚糖标准样校准)Mw为6.0 x 106
光谱数据
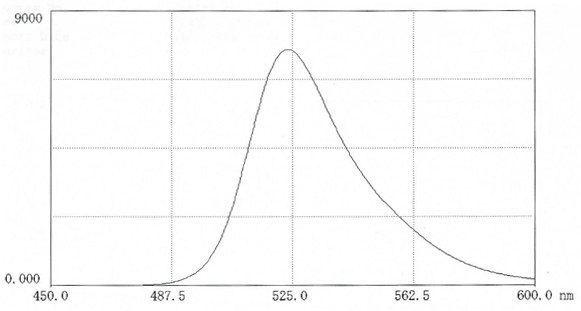
图 11.在0.025M硼酸盐pH9.0(12mg 盐溶于50ml缓冲液中)中,FITC-透明质酸的荧光扫描光谱。激发波长:495nm;发射波长:524 nm。
储存方法和稳定性
干燥产品应储存在黑暗、室温、密封容器中。 建议保质期为5年。产品溶液在37℃,pH7.5下培养1个月后,荧光素组分释放不可见48。
应用
在过去几年中,透明质酸的许多应用都出现在医学(特别是其对眼科手术做出了不可或缺的贡献)和化妆品中。 荧光素标记的透明质酸可以用作体外跟踪透明质酸生命周期的探针。 FITC标记的透明质酸制剂极大地增强了基底透过皮肤的可视性49。荧光素标记的透明质酸的其他应用也已见诸报端50-53。
TRITC标记多糖
TRITC葡聚糖
化学名:
四甲基罗丹明异硫氰酸酯
- 葡聚糖葡聚糖(3´,6´双(四甲基氨基)-3-氧代螺(异苯并呋喃-1(3H),9´-[9H]占吨]-5(或6)-基)氨基硫代甲酸酯]。
四甲基罗丹明B硫代氨基甲酰基 - 葡聚糖
CAS号:无
结构:
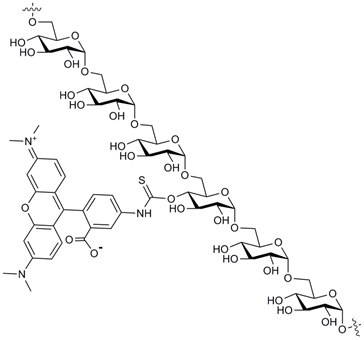
性质
通过与四甲基罗丹明B异硫氰酸酯(混合异构体)偶联,利用特选葡聚糖组分制备得到了TRITC-葡聚糖。 DS(TRITC)的范围从0.001到0.008。 在这一低取代度范围下,罗丹明部分叔氨基的电荷贡献可以忽略不计。审查了所有批次的分子量、干燥失重和游离TRITC。
光谱数据
激发最好在550nm下进行,而荧光测量在572nm处进行(图12)。我们实验室的研究表明:TRITC-葡聚糖溶液的荧光在pH 3-9的范围内只有轻微的变化(见图13)。这在进行定量测量时很有意义。在生物介质中进行测量可能会显著影响荧光强度,其有可能会增强,也有可能会减弱。

图 12.在0.025M硼酸盐pH9.0(10mg 盐溶于50ml缓冲液中)中,TRITC-葡聚糖的荧光扫描光谱。激发波长:550nm;发射波长:572 nm。

图 13.TRITC-葡聚糖的荧光强度(发射波长572nm)与pH的关系。
储存方法和稳定性
TRITC-葡聚糖的稳定性尚未有任何详细研究,但据推测其与FITC-葡聚糖应较为相似,因为两种物质的取代基均通过硫代氨基甲酰基单元进行连接。只有在高pH(> 9)和高温下,硫代氨基甲酰基键才存在水解的风险(参见FITC-葡聚糖)。TRITC-葡聚糖溶液(pH 6-7)可以在室温、黑暗中储存数周。储存在密封容器、黑暗中的干燥粉末保质期为5年。
应用
TRITC-葡聚糖主要用于细胞、血管和组织中的渗透性和运输研究。荧光的测量可以通过活体荧光显微镜定量和实时进行。该技术具有高灵敏度,可以检测到组织液中浓度低至1μg/ ml的物质。另一个重要的特性是TRITC-葡聚糖不会结合在动脉壁上54,55。
人们已证明仓鼠颊囊的微血管是由各种炎症条件所引起的血浆渗漏的有用研究模型。使用合适的过滤器(490 / 520nm),可以通过活体荧光显微镜检查脸颊囊,并用数码相机拍摄图像(参见图14)。静脉内给予5%TRITC-葡聚糖150生理盐水溶液(约100mg / kg体重)56-58。有关该技术的更多信息,请参阅Thorball3。 TRITC-葡聚糖已被广泛应用于组织和细胞的渗透性研究,我们只随机选择了少部分参考文献供您使用59-65。
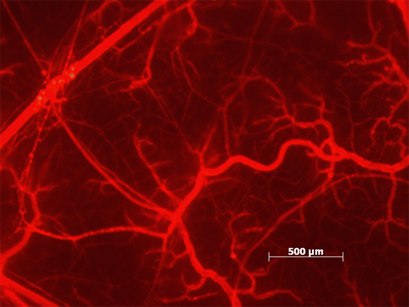
图 14.在组胺攻击15分钟后,将TRITC-葡聚糖150注射到仓鼠脸颊处。 (已获得E.Svensjö许可)
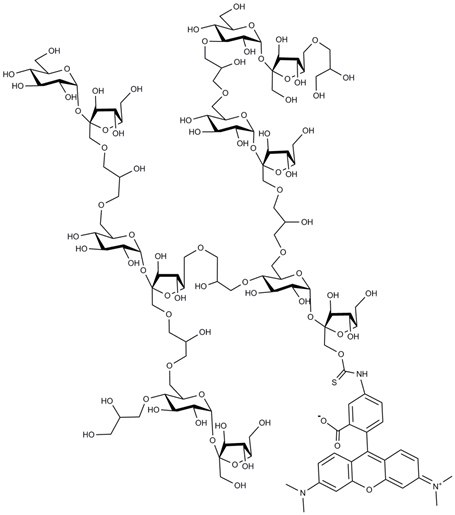
性质
TRITC-聚蔗糖是一种聚蔗糖衍生物,其是通过蔗糖与表氯醇交联合成的聚合物。 TRITC-聚蔗糖通过聚蔗糖与TRITC反应制备而成,反应条件与TRITC-葡聚糖的条件相似。TRITC-聚蔗糖可以在很宽的pH范围内易溶于水和盐溶液。 聚蔗糖比葡聚糖对酸更敏感,因此在酸性pH范围下工作时还请务必小心。其以易溶于水的红色粉末形式供应。
光谱数据
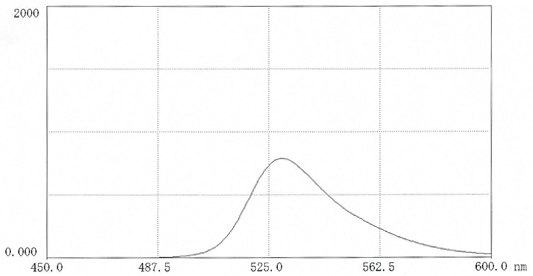
图 15.在0.025M硼酸盐pH9.0(11mg 盐溶于50ml缓冲液中)中,TRITC-聚蔗糖70的荧光扫描光谱。激发波长:522nm;发射波长:552 nm。
储存方法和稳定性
在室温、气密容器中,TRITC-聚蔗糖粉至少可以稳定储存6年。关于TRITC-聚葡萄糖在溶液中的稳定性尚未有任何详细研究报道。然而,四甲基若丹明部分和聚蔗糖之间的硫代氨基甲酰基连接基团的稳定性类似于葡聚糖上连接基团(参见TRITC-葡聚糖)的稳定性。但由于蔗糖中糖苷键的不稳定性,所以不建议将聚蔗糖基产品储存在低pH环境下。聚蔗糖本身可以在中性和弱碱性pH下高压灭菌。
应用
TRITC-聚蔗糖与FITC-聚蔗糖的应用基本相似,但其还具有某些优点。如前所述,与FITC标记物相比,四甲基若丹明的荧光对pH的依赖性较小。另外,更长的发射波长还能避免实验环境中的背景干扰。
TRITC-聚蔗糖 70已用于肾内皮屏障研究66,67。TRITC-Ficolls也已用于了胸腺非依赖性抗原的抗体应答研究68。
四甲基罗丹明透明质酸(TR-HA)
化学名:
四甲基罗丹明透明质酸
透明质素,6´双(四甲基氨基)-3-氧代螺(异苯并呋喃-1(3H),9´-[9H]占吨]-5(或6)-基)
四甲基罗丹明B透明质酸
CAS号:无
结构:
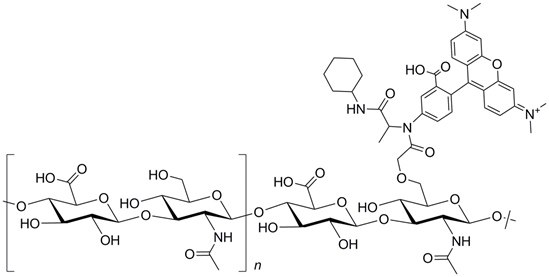
性质
自马链球菌中提取的透明质酸是一种由β(1-3)葡糖苷酸和β(1-4)氨基葡萄糖苷单元交替组成的多糖,对其用氨基-四甲基罗丹明进行标记,得到可溶于水和电解质的红色产品。DS在0.001到0.008之间。用GPC系统测定的分子量(用葡聚糖标准样校准)Mw为6.0 x 106。
光谱数据
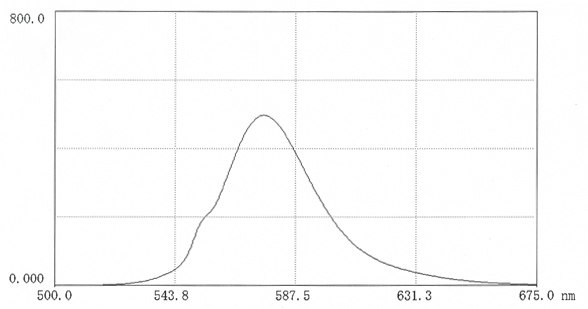
图 16.在0.025M硼酸盐pH9.0(12mg 盐溶于50ml缓冲液中)中,TR-HA的荧光扫描光谱。激发波长:552nm;发射波长:576 nm。
应用
四甲基罗丹明透明质酸(TR-HA)与荧光素透明质酸(见前面部分)的应用基本相似,但其还具有某些优点。如前所述,与FITC标记物相比,四甲基若丹明的荧光对pH的依赖性较小。另外,更长的发射波长还能避免实验环境中的背景干扰。TR-HA和双光子成像已用于脑组织的侵入性生长研究中69。
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?