二代无细胞蛋白质表达试剂盒(小麦胚芽)(CFPS700)实验方案
简介
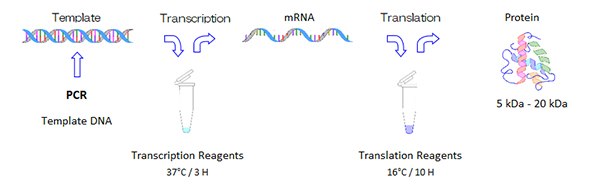
无细胞蛋白合成试剂盒分三个阶段合成蛋白:转录模板制备、转录和翻译。翻译试剂套装的使用,请见翻译部分。
制备转录模板时,必须预先准备好引物。引物可加入5种不同的标签序列,而通过2次PCR反应,就能高效构建含有多个标签序列的转录模板。还可在N端和C端连上标签。引物序列表如下。
CFPS700试剂盒实验方案的首个步骤是通过2步法PCR生成DNA模板,用于后续的转录和翻译反应。第1次PCR(1st PCR)的目标是将靶基因开放读码框(ORF)序列与第2次PCR(2nd PCR)的正向/反向引物连接(见下图)。因此,第1次PCR(1st PCR)的正向/反向引物需含有与靶基因开放读码框N端和C端序列重叠的特定基因。第2次PCR(2nd PCR)有两对正向和反向引物对。其中2种反向引物和1种正向引物为通用引物。剩下的另一种正向引物包含标签序列,例如His、FLAG或MYC标签,可通过选择不同的标签获得不同的引物。
在下文详细的实验方案中,第1次PCR(1st)基因特异性引物与ORF的重叠序列长度默认为18 bp。不过,重叠长度也可增加到30 bp,使引物选择更加丰富。第1次PCR(1st PCR)的引物对选择至关重要。假如设计不当,会导致第一次PCR效率降低甚至失败,进而导致第二次PCR失败,最终导致蛋白翻译失败。请使用引物设计工具(右击下载电子表格)为第1次PCR(1st PCR)设计引物对。工具使用方法在此。
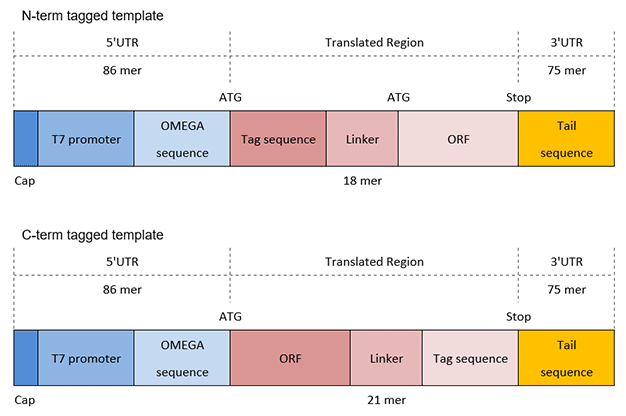
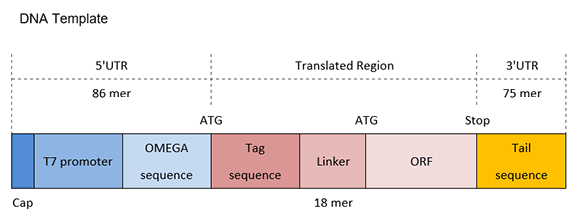
图 1.N端TAG的结构
N端TAG转录模板的引物制备方法
既然PCR分为第一次PCR和第二次PCR两个阶段,需要的引物也更多(图2)。
引物序列表(例如,His标签插入)见表2。红色标记标签(Tag)(表2,6 X His)可改为其他标签。
请注意反向引物与表1序列互补。
假如没有标签,请保留Linker(接头)。
Linker序列可改为适宜的蛋白酶识别序列。
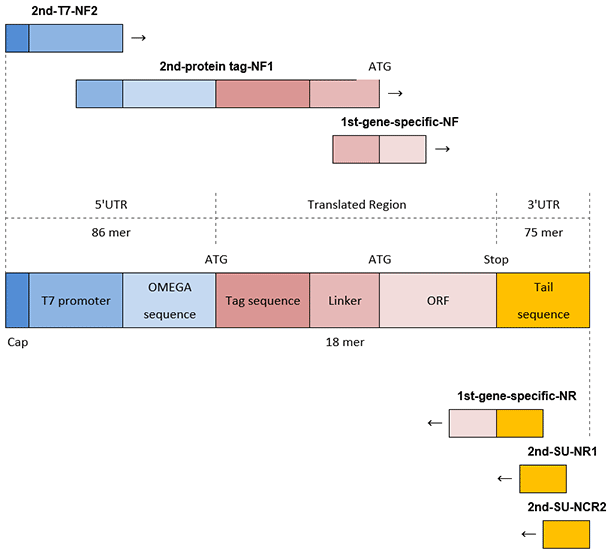
图 2.N端标记DNA模板的PCR
C端TAG DNA模板的结构
C端带Tag(标签)的DNA模板的结构和各部分的序列如图3和表3。
同N端标签一样,由于添加到开放读码框(ORF)上的长序列,引物设计和PCR较以往更为复杂。
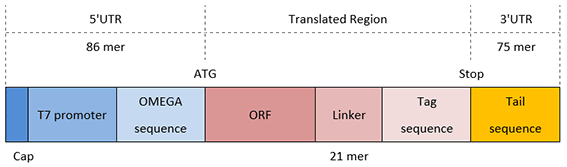
图 3.C端带标签的DNA模板
C端TAG转录模板的引物制备方法
既然PCR分为第一次PCR和第二次PCR两个阶段,需要的引物也更多(图4)。
引物序列表(例如,His标签插入)见表4。红色标记标签(表3)可改为其他标签。
请注意反向引物与表3序列互补。
假如没有标签,请保留Linker(接头)。
Linker序列可改为适宜的蛋白酶识别序列。
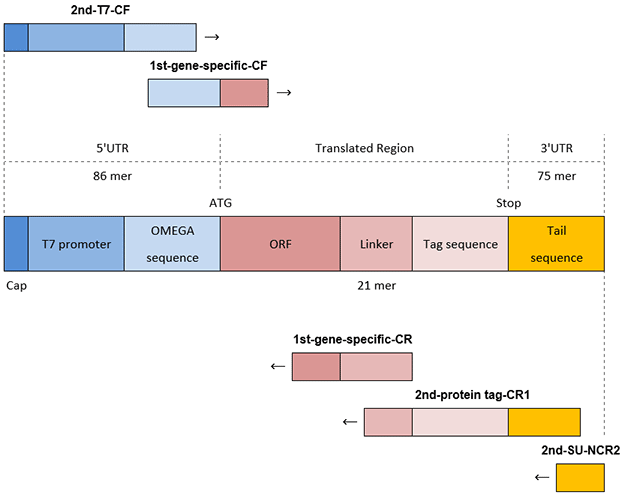
图 4.C端标记DNA模板的PCR
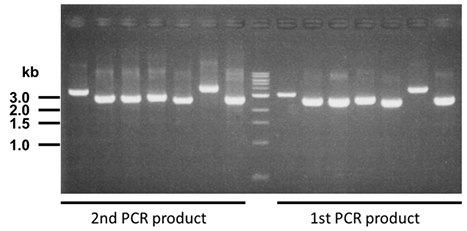
- 曝光时间:1/8 sec
- 样品:5 µL
- 1.5% TAE琼脂糖凝胶
- Quick-Load 1 kb DNA Ladder分子量标准品(BioLabs):5 µL
- 溴化乙锭(EB)染色:30 min
假如核对PCR产物后发现问题,请按下列顺序重新检查
- 检查PCR程序
- 检查制备反应溶液的各组分
- 检查PCR引物
第1次PCR
1份样品的反应配置和反应程序如下表所示。
如考虑扩增效率等因素,也可改动程序。
完成第1次PCR(1st PCR)反应后,通过琼脂糖凝胶电泳检查PCR产物(3 μL)。
在下列反应程序中,1st-gene-specific-F和1st-gene-specific-R代表用于N端标记转录模板的1st-gene-specific-NF和1st- gene-specifc-NR,用于C端标记转录模板的分别是1st-gene-specific-CF和1st-gene-specific-CR。
反应配置和PCR程序(使用KOD-Plus-Neo酶)
反应配置和PCR程序(使用PrimeSTAR酶)
反应配置和PCR程序(使用PrimeSTAR Max酶)
第2次PCR
第2次PCR使用不经过纯化和浓缩处理的第1次PCR产物
完成第2次PCR(2nd PCR)反应后,通过琼脂糖凝胶电泳检查PCR产物(3 μL)。
如考虑扩增效率等因素,也可改动程序。
*第2次PCR一般使用1 μL第1次PCR产物。
第2次PCR的各种反应程序
下列程序N端标签和C端标签通用。
N端标签的第2次PCR配置
C端标签的第2次PCR配置
转录反应
- 轻弹离心管混匀配制好的转录反应溶液,并在台式离心机中稍微离心甩下管壁贴附液体。
- 盖紧管盖,防止溶液蒸发。
- 在水浴或培养箱中37℃孵育3小时。
*标准反应时间最多3-6小时。
转录纯化
- 完成转录反应后,取1 μL转录样品进行琼脂糖凝胶电泳。
- 每份样品(25 μL)加入10 µL 4 M乙酸铵,混匀,加入100 μL 100%乙醇,上下颠倒管子混匀,接着在台式离心机中离心数秒。冰上静置20分钟。
乙酸铵是关键的中和试剂。注意,假如纯化时加入trizole、硫酸铵等试剂,mRNA会失活,导致蛋白无法合成。 - 按4 °C、15,000 rpm、20分钟离心。
- 移液弃上清,在台式离心机中离心数秒。再用移液枪小心吸弃上清,这次注意不要碰到样品沉淀。
- 让沉淀自然干燥。管盖保持开启状态,小心不要沾染杂质、灰尘等污染物。
*不得使用核酸干燥器 - 每份样品(25 μL转录反应溶液)加入80 μL无核酸酶水(焦碳酸二乙酯/DEPC水)溶解mRNA沉淀。
充分重悬沉淀,用作mRNA溶液
* 注意,mRNA可能会贴附在容易疏忽的管壁上
转录检验
- 转录检验(mRNA)
完成纯化后,通过电泳检验mRNA。
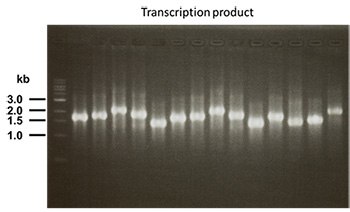
- 曝光时间:1/15 sec
- 样品:1 µL
- 1.5% TAE琼脂糖凝胶
- Quick-Load 1 kb DNA Ladder分子量标准品(BioLabs):3 µL
- 溴化乙锭(EB)染色:20 min
- 转录浓度检测。
检测浓度时,纯化样品中的酚/氯仿,以便用于翻译反应。
转录反应获得的1份目标mRNA的产量> 25 µg。
对于某些靶蛋白,转录反应可能会合成大量mRNA,但是当将这么多mRNA(40 µg或更多)用于翻译反应时,蛋白表达量反而会严重降低,或者无法获得全长蛋白。因此,建议检测和控制mRNA浓度,以下节中110 μL的翻译溶液来说(作为mRNA溶液),按每110 µL翻译反应体积,浓度应调配为25 ~ 40 µg / 80 µL,最好是30 ~ 35 µg / 80 µL的mRNA。
如使用异源mRNA进行共表达(如,异二聚体表达),例如共表达蛋白的分子量A链和分子量B链时,将各mRNA的比例设为A:B,并且总RNA约为30-35 µg / 80 µL,促进多聚体形成。
翻译
准备翻译反应溶液
如下所示,在1.5 mL离心管或PCR管中配制翻译反应溶液。
配好除mRNA以外的试剂,平衡至室温,接着加入mRNA溶液,温和重悬,勿制造气泡。
当mRNA浓度未知时,建议在1次翻译反应溶液中加入1次转录反应合成的全部mRNA。

请注意,对于110 µL反应溶液,加入超过10 µL的小麦胚芽提取物会降低翻译产量。
翻译反应(简单的批次法)
- 16 °C过夜(10小时以上)孵育管子。
- 温和地吹吸混匀样品,离心管收集,按4 °C、15,000 rpm、10分钟离心。-80 ° C储存上清
放大
在本实验方案中,1次翻译反应为110 µL,但体量可以放大。
放大时,按比例增加翻译反应试剂用量
例如,将翻译反应体积从110 µL放大到220 µL时,试剂配置为
放大后,靶蛋白的产量会提高。
例如,110 µL翻译反应产量为10 µg,550 µL的翻译反应产量随反应体积的增加而提高,约为70 µg。
翻译反应(透析法)
透析法可取代简单的批次法。在透析法中,在透析杯内加入翻译溶液(样品溶液),外部透析溶液为氨基酸混合物。外部透析溶液一般是样品量的20倍到100倍。
使用Thermo Fisher Scientific出产的Slide-A-Lyzer™迷你透析杯(0.1 mL样品,截留分子量3.5 K)时
- 将超纯水稀释4倍的2 mL氨基酸混合物加入24孔微孔板的1孔中,盖上板子。*由于2 mL离心管与透析杯类似,透析法可用2 mL离心管进行。
- 将透析杯挤进板盖中。
- 取配好的全部110 μL翻译反应溶液,温和地加入透析杯以免产生气泡,移液枪按2下就会制造气泡。接着盖好透析杯盖子。使样品溶液(反应层)与外部透析液(氨基酸混合物)的液面水平保持一致,或样品溶液层略低。
- 16 °C过夜(10小时以上)孵育。
另外,在24孔微孔板上钻9mm孔,刚好可以放置透析杯,如果不好钻孔,可改用离心管浮动架。

蛋白检验
如下所示,通过丙烯酰胺凝胶电泳检验翻译产物。
- 完成翻译反应后,补加超纯水将翻译反应溶液提升至3倍,温和搅拌。
- 按4 °C、15,000 rpm、20 min离心,收集上清。
- 在丙烯酰胺凝胶上样1-2 µL,开始电泳
- 染色法检测。
分步说明
第1步. 补加的用处包括节约检测样品、避免加样过量和溶解未溶成分。提升至3倍后,反应溶液仍维持缓冲能力,不过超过这个量后就要小心。如非必要,此步可跳过。
第2步.沉淀物中除了小麦胚芽成分以外,还可能包含不溶物。视需要用适宜的缓冲液重悬沉淀,回收目标产物。对上清回收的目标产物量有疑虑时,该措施可增加溶解率和优化翻译反应溶液。
第3步.蛋白质免疫印迹、银染、考马斯亮蓝染色法都使用1-2 µL电泳样品检测。除了免疫染色外,这些方法还会检测到小麦胚芽成分,因此建议不要上样过多。
下为使用该试剂盒合成FLAG®融合蛋白,用FLAG®抗体进行蛋白质免疫印迹分析后的结果。

二代无细胞蛋白质表达试剂盒(小麦胚芽)(CFPS700)仅供研究使用。
KOD®和KOD-Plus-Neo是Toyobo Co., Ltd.所有的注册商标或商标名。
PrimeSTAR®和PrimeSTAR® MAX 是Takara Bio Inc.所有的注册商标或商标名。 FLAG®是Sigma-Aldrich Co. LLC.所有的注册商标名。Slide-A-Lyzer ™是Thermo Fisher Scientific Inc所有的商标名。
其他提及的公司名称和产品名称或是各公司所有的商标和注册商标名。
并非所有试剂等产品都已标示商标(®, ™)。
产品清单
如要继续阅读,请登录或创建帐户。
暂无帐户?