溶解度规则 | 常见离子化合物的溶解度
溶解度化学原理
了解化学物质在水溶液中的相互作用方式非常重要。一些化合物或溶质会溶解,其他化合物或溶质会形成沉淀或固体,还有一些会与水反应。
您在日常生活中可能遇到过各种溶解度问题。无法均匀溶解在水中的热巧克力或调味饮料干混粉,就是典型的非必要沉淀物。矿物质含量较高的水蒸发后,此前溶解的金属阳离子形成碳酸盐或与肥皂阴离子结合,留下水垢或肥皂浮渣沉淀物。
溶解度在许多实验室工艺中会用到,在医学中同样很重要。有些离子从溶液分离后可能有毒,但形成化合物却很有帮助。
饱和溶液是溶解溶质量达到上限的溶液。与之相对的是稀释溶液;可容纳更多溶质。
压力和温度都会影响溶解度。本页讨论室温和标准压力下,不同化合物在水中的溶解度。溶于水的化合物形成水溶液。
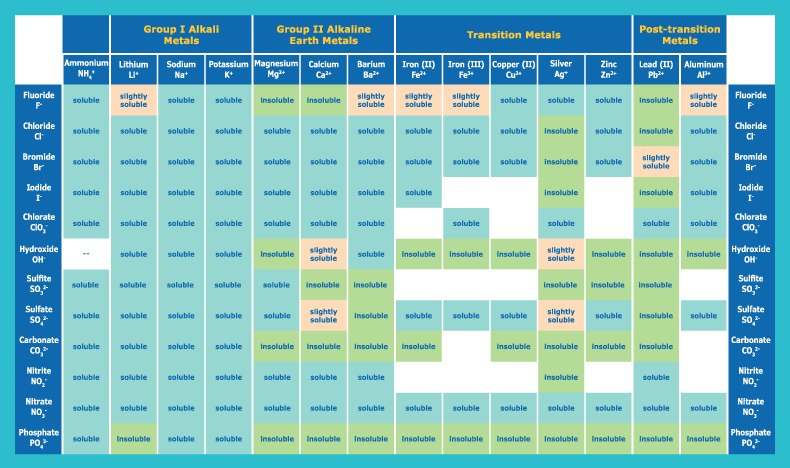
溶解度规则
如何利用溶解度规则
确定您要查看溶解度的化合物。总结出经验公式很有帮助,方便您发现组成化合物的离子。
在溶解度规则中查找对应离子。查看左列的一般规则,并留意右列确保未遗漏任何例外情况。
也可在溶解度表中查找离子。您可能会发现这样更轻松。阳离子排列在顶部,阴离子沿垂直方向排列。找到阳离子列和阴离子行相遇的单元格,确定相应化合物的溶解度。
我们的溶解度规则并不齐全。如需查找不太常见的化合物,可能需要参考元素周期表。
溶解度规则表
下载溶解度图表供学习和课堂使用
我们的基本溶解度表可免费下载。可随意与朋友、学生或老师分享。只需确保保留此页面链接即可。
想提供一些关于我们的学习工具的反馈?使用上方链接联系我们或在我们的社交媒体帐户下发表评论。
溶解度定义
讨论溶解度时,最好遵循约定的标准定义。上述资源提供了一些一般规则和宽泛定义。
美国药典 (USP)是一家致力于制定药品、食品成分、膳食补充剂产品和成分标准的非营利组织,其拟定的定义如下。这些定义被全球其他主要药典机构沿用,且通常与精确的测量方法结合使用,以满足更精确的应用需求。
登录以继续。
如要继续阅读,请登录或创建帐户。
暂无帐户?