Annealing Oligos Protocol

What is Annealing?
Annealing oligos is a critical step in molecular biology because it facilitates the formation of double-stranded DNA from complementary single-stranded oligonucleotides. This process is essential for accurate downstream applications, such as PCR, gene cloning, and sequencing, where the correct base pairing of DNA strands is required. Without proper annealing, mismatches or incomplete hybridization can occur, leading to reduced efficiency, errors in amplification, or incorrect gene synthesis. Additionally, oligo annealing ensures that DNA fragments are stable and ready for enzymatic reactions, such as ligation or replication, making it a foundational technique in genetic research and biotechnology.
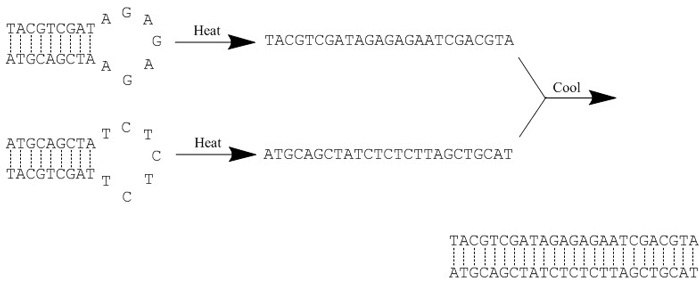
Figure 1.Example of an annealing reaction. Heat ‘breaks’ all hydrogen bonds, thereby disrupting any secondary structure within each oligonucleotide. Slow cooling then facilitates hybridization as new hydrogen bonds form between the complementary sequences.
Definitions/Abbreviations
- EDTA: Ethylenediaminetetraacetic acid
- NaCl: Sodium Chloride
- Trizma® base: Brand name for Tris [Tris(hydroxymethyl)aminomethane]
- Oligo: Abbreviation of oligonucleotide or oligomer. Oligonucleotides are short, single-stranded DNA or RNA molecules that must be annealed (heated or melted) so they can bond and form a double strand with an appropriate complementary DNA or RNA strand.
- DNA annealing: This page discusses the annealing process for all oligonucleotides. Sometimes annealing is referred to as DNA annealing even though the process is used for RNA as well. Annealing is the process of heating and cooling two single-stranded oligonucleotides with complementary sequences. Heat breaks all hydrogen bonds, and cooling allows new bonds to form between the sequences.
DNA/RNA Annealing Equipment and Supplies
- Heat block or thermocycler
- 2 mL centrifuge tubes
- Pipette tips
- Milli-Q® H2O
- EDTA (Product No. E9884)
- NaCl (Product No. S3014)
- Trizma® base (Product No. 93362)
- Two single-stranded oligonucleotides with complementary sequences
DNA/RNA Annealing Method
The annealing process is divided into two main steps: 1) dissolution, and 2) annealing, either by heat block or thermocycler.
Oligo Dissolution
Although each oligonucleotide comes in a measured amount, for best results, verify it with a spectrophotometer to ensure that equal amounts of each oligonucleotide are added to the reaction.
- Dissolve each oligonucleotide in a volume of Annealing Buffer (see the buffer recipes below) so that each has the same concentration.
- The concentration of each oligonucleotide needs to be 2X the desired concentration of the duplex oligonucleotide.
Example
The desired concentration of the duplex oligonucleotide is 50 µM.
- Oligonucleotide 1: delivered with 10.55 OD (312.6 µg, 49.9 nmol); verify measured OD amount with spectrophotometer.
- Oligonucleotide 2: delivered with 9.04 OD (279.7 µg, 45.9 nmol); verify measured OD amount with spectrophotometer.
- Each oligonucleotide stock solution needs to be 2X the desired duplex oligonucleotide concentration, i.e. each stock solution needs to be 100 µM.
- For oligonucleotide 1, add 49.9 x 10 = 499 µL of Annealing Buffer to create a 100 µM stock solution.
- For oligonucleotide 2, add 45.9 x 10 = 459 µL of Annealing Buffer to create a 100 µM stock solution.
*This calculation is a shortcut that only works for creating 100 µM solutions and is used here for example purposes only. To learn more about calculating different oligonucleotide concentrations, see Handling Guidelines & Stability.
Oligo Annealing
Heat Block
- Mix equal volumes of the equimolar oligonucleotides in a microtube.
- Incubate the microtube at 95 °C for 5 min.
- Allow the microtube to slowly cool to room temperature (<60 min).
Thermocycler
Although a heat block will work, a thermocycler allows for a more consistent process.
- Mix equal volumes of the equimolar oligonucleotides in a PCR tube.
- Use the following thermal profile:
- Heat to 95 °C and maintain the temperature for 2 min.
- Cool to 25 °C over 45 min.
- Cool to 4 °C for temporary storage.
- Heat to 95 °C and maintain the temperature for 2 min.
- Centrifuge the PCR tube briefly to draw all moisture away from the lid.
Following deployment of the heat block or thermocycler, the duplex oligonucleotide is now ready to use or stored. To learn more about storing oligonucleotides, see Handling Guidelines & Stability.
Buffer Recipes for DNA Annealing and Explanation of Components
Make all buffers with Milli-Q® water.
Annealing Buffer Composition (1X)
For DNA annealing, buffers typically contain salts and stabilizing agents to ensure optimal hybridization of oligonucleotides. A common recipe is:
- 10 mM Tris-HCl (pH 7.5-8.0) – maintains a stable pH for the reaction.
- 50 mM NaCl – provides the necessary ionic strength to promote hybridization.
- 1 mM EDTA – chelates divalent cations to prevent degradation by nucleases.
To anneal oligos, mix them in this buffer, heat to 95°C for 2-5 minutes, then gradually cool to room temperature, allowing the oligos to hybridize into stable double-stranded DNA. Make all buffers with Milli-Q® Type I water.
Ligase Buffer Composition (1X)
A standard ligase buffer recipe typically includes the following components:
- 50 mM Tris-HCl (pH 7.5-8.0) – provides a stable pH environment for the ligation reaction.
- 10 mM MgCl₂ – essential as a cofactor for DNA ligase activity.
- 10 mM DTT (Dithiothreitol) – helps maintain the reduced state of the ligase enzyme.
- 1 mM ATP – required as an energy source for the ligation process.
- 25 µg/mL BSA (optional) – stabilizes the enzyme during the reaction.
This buffer supports optimal ligation conditions, enabling DNA fragments to be efficiently joined together.
Kinase Buffer Composition (1X)
A typical kinase buffer recipe includes the following components:
- 50 mM Tris-HCl (pH 7.5) – maintains an optimal pH for kinase activity.
- 10 mM MgCl₂ – serves as a necessary cofactor for kinase function.
- 5 mM DTT (Dithiothreitol) – keeps the enzyme in its active, reduced state.
- 1 mM ATP – provides the phosphate group for phosphorylation reactions.
This buffer ensures efficient phosphorylation of substrates, commonly used in reactions involving polynucleotide kinase (PNK) to add phosphate groups to DNA or RNA ends.
Related Products
References
To continue reading please sign in or create an account.
Don't Have An Account?