磷酸酶抑制剂混合物
简介
磷酸化是一种可逆的蛋白质翻译后修饰。蛋白质激酶催化带负电荷的γ-磷酸基团从ATP转移到蛋白质的丝氨酸、苏氨酸或酪氨酸残基的羟基侧链,从而改变蛋白质的构象和活性。逆反应则由蛋白质磷酸酶完成,即从蛋白质中除去磷酸盐,亦称为去磷酸化。百分之三到四的哺乳动物蛋白质是激酶和磷酸酶1,2,有些对少数靶蛋白具有特异性,而其他则广泛地作用于许多蛋白质。
蛋白质磷酸化是控制蛋白质活性、相互作用、定位和降解的关键调节机制。它控制信号转导、细胞周期、细胞凋亡、代谢等过程。存在于典型哺乳动物细胞中的约三分之一的蛋白质被磷酸化,其中许多在多个位点上。丝氨酸磷酸化占磷酸化蛋白质组的86%,而苏氨酸和酪氨酸磷酸化分别为12%和2%。许多人类疾病与细胞蛋白质的异常磷酸化有关。3-5
细胞利用蛋白质的磷酸化 / 去磷酸化作为控制机制有许多优势。这种机制快速,不需要新蛋白质的合成或蛋白质的降解,并且是可逆反应。
当研究涉及蛋白质磷酸化的细胞过程(如信号级联和蛋白质-蛋白质相互作用)时,或者分析蛋白质上的磷酸化位点和磷蛋白质纯化时,必须通过磷酸酶抑制剂抑制细胞蛋白质磷酸酶。这样能够在选定的时间点冻结靶蛋白的磷酸化状态。磷酸化数据库www.phosphosite.org报告了80,000个磷酸化位点。如果不使用磷酸酶抑制剂,它们中的大多数都无法检测。
蛋白质磷酸酶
蛋白质磷酸酶根据其底物特异性分为多个亚类(见表1)。
- 碱性磷酸酶6-8 — 非特异性磷酸酶家族,负责从许多类型的分子(包括蛋白质、核苷酸和生物碱)中去除磷酸基团。哺乳动物碱性磷酸酶同工酶被高精氨酸和左旋咪唑类似物抑制。然而,肠和胎盘同工酶不受左旋咪唑的抑制,但被咪唑抑制。
- 蛋白质丝氨酸 / 苏氨酸磷酸酶9,10 — 这类磷蛋白质磷酸酶占体内丝氨酸 / 苏氨酸磷酸酶活性的大部分。它包括两个主要的子类PP1和PP2。后者根据金属离子要求进一步细分:不需要金属离子的是PP2A;钙刺激的是PP2B;依赖Mg2+的是PP2C。丝氨酸 / 苏氨酸磷酸酶被来自海绵、土壤链霉菌等的许多小分子抑制。最着名的是冈田酸、花萼海绵诱癌素A、微囊藻毒素-LR、变构霉素、磷烯菌素和斑蝥素。这些化合物的活性对各种丝氨酸 / 苏氨酸磷酸酶具有不同的特异性。11
- 蛋白质酪氨酸磷酸酶12 — 是一组酶,使用半胱氨酰磷酸酯酶中间体从蛋白质上的磷酸化酪氨酸残基上除去磷酸基团。这些酶是信号转导途径中的关键调节成分。原钒酸盐和相关化合物以及氟化钠可抑制酪氨酸磷酸酶。
- 双特异性(酪氨酸和丝氨酸 / 苏氨酸)磷酸酶3 — 双特异性磷酸酶是蛋白质酪氨酸磷酸酶的亚类,其也能够使丝氨酸和苏氨酸残基去磷酸化。它们参与关键细胞信号传导途径的调节。这些抑制剂的具体实例可参见参考文献。13
实验结果
以下实验数据比较了新磷酸酶抑制剂混合物3与它所取代的磷酸酶抑制剂混合物1(货号 P2850)。数据显示两种混合物的活性相当。
值得一提的是,为了抑制多种磷酸酶并有效降低总磷酸酶活性,建议使用我们的两种磷酸酶抑制剂混合物,即磷酸酶抑制剂混合物2(货号P5726)和磷酸酶抑制剂混合物3(货号 P0044)。
使用放射性底物 32P-Ser 磷酸化酶 A 在 pH 7.5、30 °C 下测量各种细胞和组织提取物中的内源性 PP1α 样活性。 在测定 PP1α 样活性前 5 分钟,在 30 °C 下将磷酸酶抑制剂混合物 1(货号 P2850)或磷酸酶抑制剂混合物 3(货号 P0044)加入提取物,至终浓度1%。图1中显示的活性是相对的而非绝对的。剩余的活性越小,放入反应中的混合物的抑制程度越大。
* 对于这些样品观察到的值太低,无法在图中看到,非常接近于零。
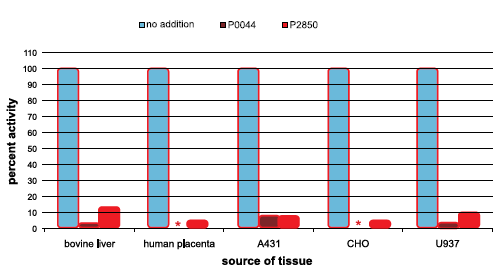
图 1.细胞和组织提取物中PP1α样活性的抑制
抑制蛋白质磷酸酶1α样活性
磷酸酶抑制剂混合物(货号P0044)是细胞和组织中蛋白质磷酸酶1α样活性的有效抑制剂。以下实验显示了其抑制效率,并将其与前一种磷酸酶抑制剂混合物1(货号P2850)。
人胎盘显示出每mg蛋白质的PP1α样活性比其他组织提取物高10-20倍。因此,选择它来显示磷酸酶抑制剂混合物的抑制效率。
使用放射性底物P-Ser磷酸化酶 A 在 pH 7.5、30 °C 下测量人胎盘提取物中的内源性 PP1α 样活性。 在测定 PP1α 样活性前 5 分钟,在 30 °C 下将不等量的磷酸酶抑制剂混合物 1(货号P2850)或磷酸酶抑制剂混合物 3(货号P0044)加入提取物。
使用pNPP底物在pH 10.4、37℃下,用比色测定法测量了牛肝提取物中的内源性AP样活性。测定 AP样活性前,在 30 °C 下将只含有磷酸酶抑制剂混合物3(货号P0044)或同时含有磷酸酶抑制剂混合物2(货号P5726)的提取物孵育 3 分钟,进行抑制反应。
抑制碱性磷酸酶(AP)样活性
如上所述,不同的抑制剂抑制不同的碱性磷酸酶同工酶。磷酸酶抑制剂混合物3(货号 P0044)强烈抑制牛肝提取物中存在的碱性磷酸酶的L-同种型,并且在添加了磷酸酶抑制剂混合物2(货号 P5726)(图3A)后表现出协同效应。
磷酸酶抑制剂混合物3(货号 P0044)对人体胎盘提取物中富含的具有碱性磷酸酶活性的P-同种型的抑制作用很小,因此通过使用磷酸酶抑制剂混合物2(货号 P5726(图3B)可实现抑制作用。
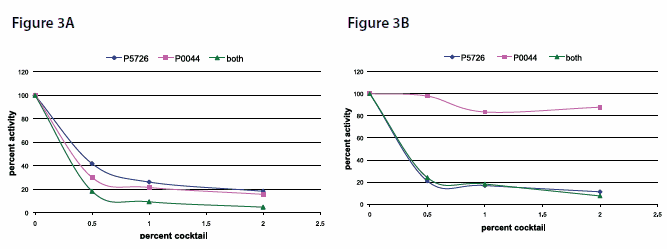
图3A和B. 对牛肝提取物中碱性磷酸酶(AP)样活性的剂量依赖性抑制
材料
如要继续阅读,请登录或创建帐户。
暂无帐户?