Duolink® PLA Multicolor Detection Protocol
This protocol describes the use of Duolink® PLA Multicolor reagents for the simultaneous detection, visualization, and quantification of up to four proteins, protein modifications, and/or protein interactions in a single tissue or cell sample.
Materials and Equipment
Duolink® PLA Reagents
To run a Duolink® PLA Multicolor experiment, the following Duolink® PLA Multicolor products are needed:
- Two to four Duolink® PLA Multicolor Probemaker Kits (choose from Red, Green, Orange, and/or FarRed). Each kit includes:
- Duolink® PLA Multicolor Oligonucleotides Two vials of lyophilized, activated oligos for conjugation to primary antibodies:
Red Oligo A and Red Oligo B,
Green Oligo C and Green Oligo D,
Orange Oligo F and Orange Oligo G, or
FarRed Oligo H and FarRed Oligo I - Conjugation Buffer – For buffering the conjugation reaction
- Stop Reagent – For stopping the conjugation reaction
- Storage Solution – For preserving the oligo-conjugated antibody (PLA probe)
NOTE: Store all kit components at -20 °C. See the Duolink® PLA Probemaker Guide for Multicolor Detection for details on how to conjugate specific pairs of oligos to primary antibodies. Once the antibodies are conjugated, store the prepared PLA probes at +2-8 °C. Do not freeze.
- Duolink® PLA Multicolor Oligonucleotides Two vials of lyophilized, activated oligos for conjugation to primary antibodies:
- Duolink® PLA Multicolor Reagent Pack. Each kit includes:
- Ligation Stock (5X) – Diluted to make 1X Ligation Buffer
- Ligase (1 U/μL) – Added to make the Ligation Solution
- Amplification Stock (5X) – Diluted to make 1X Amplification Buffer
- Polymerase (10 U/μL) – Added to make the Amplification Solution.
- Blocking Solution – For blocking the sample before antibody incubations
- Probemaker PLA Probe Diluent – For dilution of custom PLA probes
- Detection Stock (5X) - Diluted to make 1X detection buffer
NOTE: The 1X Blocking Solution and 1X Probemaker PLA Probe Diluent can be stored at +2-8 °C upon receipt. Store all other components at -20 °C.
- Wash Buffers for Fluorescence (A and B)
- Duolink® Mounting Media with DAPI (for use on slides, store at +2-8 °C) or Nuclear Stain and Anti-fade (for use in microplates, store at -20 °C)
Additional Materials
- Primary antibodies of choice to detect the protein(s) of interest
- High purity water (sterile filtered, Milli-Q® water or similar)
- Sample (cells or tissue) on a slide, pre-treated with respect to fixation, retrieval, and permeabilization
Equipment
- Fluorescence microscope with appropriate filters, camera, and software for image acquisition
- 37 °C incubator
- Orbital shaker
- Heated humidity chamber or Microplate Heat Transfer Block
- Hydrophobic pen for delimiting the reaction area
- Freezer block (for enzymes)
- Staining jars
- Forceps
- Pipettes and tips (from 1 μL to 1000 μL)
- Coverslips compatible with fluorescence microscopy
Duolink® PLA Multicolor Detection Protocol
The following protocol is for a 1 cm2 sample on a slide, requiring 40 µL of solution for adequate coverage.
Adjust the volume according to your reaction area and number of samples. All incubations should be performed in a humidity chamber. Perform all wash steps at room temperature in a staining jar with at least 70 mL wash buffer with gentle agitation.
Reagent Preparation
Wash Buffers A and B should be made before beginning the assay by dissolving the contents of one pouch in high purity water to a final volume of 1,000 mL. Solutions may be stored at room temperature for short term storage (less than two weeks) or at +2-8 °C for long term storage.
NOTE: Bring the solutions to room temperature before use.
- 0.01X Wash buffer B should be made before beginning the assay by diluting 1X Wash Buffer B 1:100 in high purity water.
- Many Duolink® PLA reagents are supplied as concentrated stocks and are to be diluted immediately before use. Do not store diluted Duolink® PLA reagents.
Multicolor Duolink® PLA Protocol
Before starting, the samples should be deposited on glass slides and pre-treated with respect to fixation, retrieval, and/or permeabilization.
- Blocking
NOTE: Tighten the lid on the 1X Blocking Solution before use as the dropper may have become dislodged during the freezing and thawing. Store at +2-8 °C.- Add 1 drop (~40 µL) of Duolink® Blocking Solution to each 1 cm2 sample. Be sure to cover the entire sample with Blocking Solution.
- Incubate the slides in a heated humidity chamber for 60 minutes at 37 °C.
- Primary Antibody Incubation
NOTE: Do not allow the slide to dry before adding antibody as this can cause background- Dilute all of the oligo-conjugated primary antibodies together in the Probemaker PLA Probe Diluent. Use concentrations that resulted in optimal antibody performance by singleplex Duolink® PLA.
- Tap off the Blocking Solution from the slides.
- Add the primary antibody solution to each sample.
- Incubate the slides in a humidity chamber. Use the optimal incubation temperature and time that is suitable for all primary antibodies.
- Ligation
NOTE: Wait to add the ligase until immediately before adding to the sample. Make sure ligation buffer is completely thawed before use.- Tap off the primary antibody solution from the slides.
- Wash the slides 3x 5 minutes in 1x Wash Buffer A at room temperature.
- During the wash, make the ligation solution. Vortex the 5x Multicolor PLA Ligation Buffer.
- Dilute the 5x Multicolor PLA Ligation buffer 1:5 in high purity water and mix. For a 40 µL reaction, add 8 µL of the 5x Ligation buffer to 30 µL of high purity water (minus the volume of the ligase). Make sufficient solution for all samples.
- Retrieve the Ligase from the freezer using a freezer block (-20 °C).
- Dilute the Ligase 1:20 in the 1x Ligation buffer and mix. For 40 µL ligation solution, add 2 µL of Ligase to 38 µL of the 1x ligation buffer.
- Tap off excess wash buffer and apply the ligation solution.
- Incubate the slides in a pre-heated humidity chamber for 30 minutes at 37 °C.
- Amplification
NOTE: Wait to add the polymerase until immediately before adding to the sample.- Tap off the ligation solution from the slides.
- Wash the slides 3x 5 minutes in 1x Wash Buffer A at room temperature.
- During the wash, make the amplification solution. Vortex the 5x Amplification buffer.
- Dilute the 5x Amplification buffer 1:5 in high purity water and mix. For 40 µL reaction, add 8 µL of the 5x Amplification buffer to 31 µL of high purity water (minus the volume of the polymerase). Make sufficient solution for all samples.
- Retrieve the Polymerase from the freezer using a freezer block (-20 °C).
- Dilute the Polymerase 1:40 in the 1x amplification buffer and mix. For 40 µL reaction, add 1 µL of Polymerase to 39 µL of the 1x amplification buffer.
- Tap off excess wash buffer and apply the amplification solution.
- Incubate the slides in a pre-heated humidity chamber for 100 minutes at 37 °C.
- Detection
NOTE: The Multicolor PLA Detection buffer is light-sensitive. Protect all solutions containing buffer from light.- Tap off the amplification solution from the slides.
- Wash the slides 3x 5 minutes in 1x Wash Buffer A at room temperature.
- During the wash, make the detection solution. Vortex the 5X Multicolor PLA Detection buffer.
- Dilute the 5X Multicolor PLA Detection buffer 1:5 in high-purity water and mix. For 40 µL reaction, add 8 µL of the 5x Detection buffer to 32 µL of high purity water. Make sufficient solution for all samples.
- Tap off excess wash buffer and apply the detection solution.
- Incubate the slides in a pre-heated humidity chamber for 30 minutes at 37 °C.
- Final Washes
NOTE: Light-sensitive reagents. Keep the slides protected from light at all times- Tap off the detection solution from the slides
- Wash the slides 2x 10 minutes in 1x Wash Buffer B at room temperature
- Wash the slides in 0.01X Wash Buffer B for 1 minute
- Preparation for Imaging
NOTE: Duolink® In Situ Mounting Media with DAPI is aqueous and does not solidify. Clear nail polish can be used to seal the edges of the coverslip to the slide. Avoid getting air bubbles caught under the coverslip.- Tap off excess wash buffer from the slides.
- Mount the slides with a coverslip using a minimal volume of Duolink® PLA Mounting Medium with DAPI.
- Wait for 15 minutes before analyzing in a fluorescence or confocal microscope, using at least a 20X objective.
Results
Image Acquisition
The results from a Duolink® PLA Multicolor experiment are viewed using a fluorescence microscope with the appropriate filters for the detection fluorophores used. The Duolink® PLA signals are recognized as discrete fluorescent spots in various cellular locations (Figure 1A). Individual signals are of sub-micrometer size and may be in multiple focal planes. Thus, it may be necessary to obtain images throughout the entire thickness of the sample. Of note, no PLA signals should be detected when the direct detection method is used in Duolink® PLA (i.e., when oligo-conjugated primary antibodies are omitted). Biological controls should be included when possible (Figure 1B).

Figure 1. SK-OV3 cells were stimulated with EGF (A) or unstimulated as a biological control (B). Duolink® PLA Multicolor detection of EGFR-HER2 interactions (green), phosphorylation of EGFR (orange), and phosphorylation of HER2 (far red) are shown. Nuclei were DAPI-stained (blue).
The acquisition settings (exposure time, gain, etc.) for each fluorochrome may be different, based on signal intensity. However, it is important that the same, optimized settings for each fluor are used to capture images across all samples within an experiment. Settings can be optimized using positive and negative controls. If the number of PLA signals is large, the PLA signals can merge/coalesce (Figure 2). This can occur when studying highly expressed proteins or during image capture due to overexposure. Care must then be taken to set the acquisition settings and proper primary antibody titer to obtain individual PLA signals.
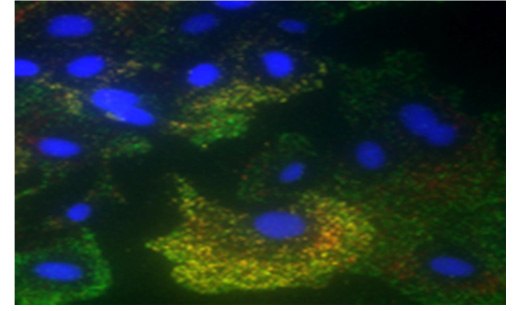
Figure 2.Duolink® PLA Multicolor detection of EGFR (green), HER2 (orange), and GAPDH (red) in unstimulated SK-OV3 cells are shown. Nuclei were DAPI-stained (blue).
There are several image analysis tools available that can be used to quantify PLA signals. The image data can be analyzed for the mean fluorescence intensity of the PLA signals and/or the total number of PLA signals per cell or per area within the cell (Figure 3). Quantification is then reported as relative to technical and/or biological controls within a given experiment. However, reliable quantification is only possible if the PLA signals have not coalesced and the image pixels have not become saturated.
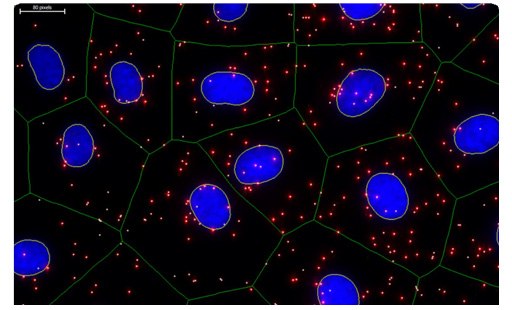
Figure 3.Image analysis using imaging software. The DAPI-stained nuclei (blue) were automatically detected and the cytoplasm size was estimated by the user (green outlines). PLA signals (red) represent the protein target of interest. The PLA signals marked with white dots and the nuclei outlined in yellow were quantified during analysis.
Materials
References
Multiplex PLA papers:
To continue reading please sign in or create an account.
Don't Have An Account?