抗体简介:抗原、表位和抗体
抗原
术语抗原(antigen)源自于antibody generation(抗体生成),指任何能够引发免疫反应(例如,产生特定抗体分子)的物质。根据定义,抗原(Ag)能够与其所处环境内的特异性抗体结合。
通常,抗原是通过感染进入宿主体内的外源性蛋白质或蛋白质片段。但在部分情况下,体内自有蛋白质也可构成抗原,诱导自身免疫反应。细菌和病毒的表面或内部含有抗原。可从中分离这类抗原,用其开发疫苗。
抗原分子量通常较高,通常为蛋白质或多糖。此外,多肽、脂质、核酸和许多其他材料也可形成抗原。部分较小的物质(所谓的半抗原)与较大分子量的载体蛋白(例如牛血清白蛋白、钥孔血蓝蛋白(KLH)或其他合成基质)化学偶联,也可能产生免疫反应。药物、单糖、氨基酸、小分子多肽、磷脂或甘油三酯等各类分子也可发挥半抗原的作用。因此,只要时间充裕,几乎所有外来物质都可被免疫系统识别并诱导产生特异性抗体。但这类特异性免疫反应高度不稳定,很大程度取决于抗原的大小、结构和组成。蛋白质或糖蛋白能够产生强烈的免疫反应,是公认最适宜的抗原;换而言之,它们具有强免疫原性。抗原通过两个不同过程被宿主识别:(1)通过B细胞及其表面抗体(sIgM);(2)通过T细胞上的T细胞受体。尽管B细胞和T细胞可能对同一抗原产生免疫反应,但作用的分子部位不同。B细胞表面抗体可以识别蛋白质的三级结构。而T细胞则需要被抗原提呈细胞吸收并降解为可识别的抗原片段。常用的抗原提呈细胞是巨噬细胞和树突细胞。免疫反应如图1所示。更多有关抗体天然生产工艺的详情,请参阅适宜的免疫学书籍内容。
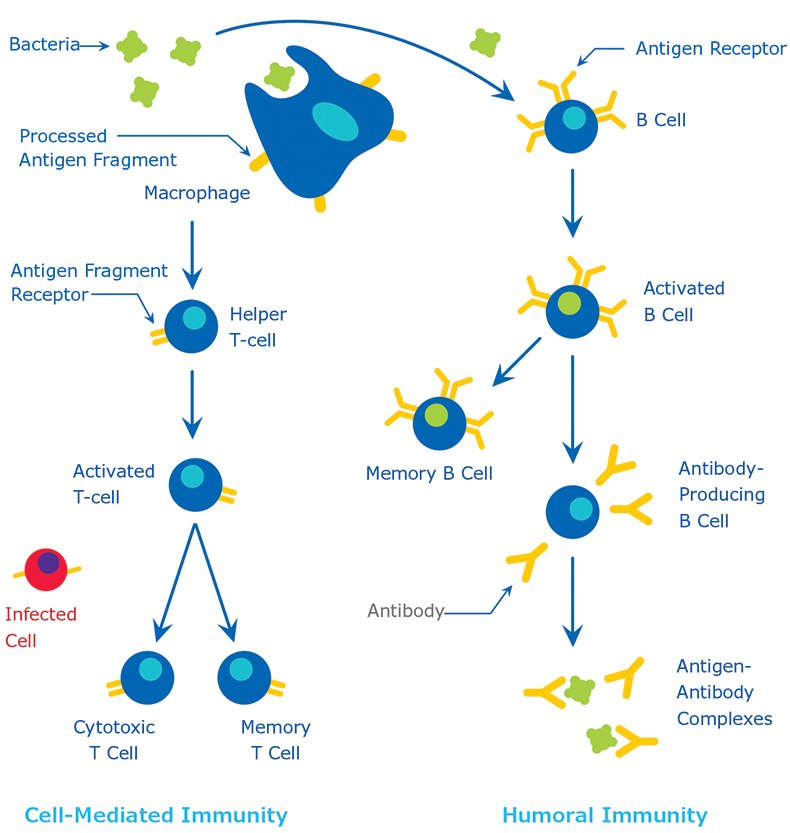
图 1.免疫反应。
表位
抗原上可被互补抗体特异性结合的小位点称为表位或抗原决定簇,通常是抗原表面上的一至六个单糖或五至八个氨基酸的残基。由于抗原分子处于空间环境中,抗体识别的表位可能取决于实际存在的三维抗原构象(例如,由两个天然蛋白质环或亚基相互作用形成的独特位点)。这就是所谓的构象表位。表位也可对应于简单的氨基酸线性序列,这种表位称为线性表位。
靶标分子(抗原)上可能的结合位点范围广泛,每个潜在的结合位点都因自身共价键、离子键、亲水性和疏水性相互作用而具有独特的结构特性。事实上,这些结构性质对于抗体选择和性能存在重要影响。为确保靶标抗原和抗体间有效相互作用,表位必须易于结合。
如果靶标分子发生变性(例如,通过固定、还原、pH变化变性,或在凝胶电泳制备期间发生变性),表位可能改变并进而影响其与抗体相互作用的能力。例如,部分抗体在蛋白质免疫印迹(WB)应用中无效,但可用于免疫组织化学(IHC)应用。因为在IHC操作步骤中,可能会在组织中保留一个复合抗原位点,而在WB操作步骤中,样品制备过程足以改变蛋白质构象并破坏抗原位点,从而消除抗体结合能力。
在变性蛋白质中,抗体只能识别线性表位。因此在使用变性蛋白质的操作方案(例如蛋白质免疫印迹)中,应首选识别线性表位的抗体。有时表位还可能位于折叠蛋白质内部,因而抗体无法通过免疫沉淀等非变性操作方案接触到此表位。根据定义,构象表位位于折叠蛋白质外部。识别构象表位的抗体适用于温和的非变性操作步骤,例如免疫沉淀或流式细胞术。
理想情况下,识别正常折叠蛋白质表面线性表位的抗体同时适用于非变性和变性操作方案。因此,表位可能存在于抗原的天然细胞环境中,或可能仅在变性时暴露。抗原可能以天然的细胞质(可溶性)、膜结合或分泌形式存在。表位的数量、位置和大小取决于在抗体生产工艺递呈的抗原量。
了解靶标蛋白、抗体识别的表位、序列保守性和技术原理,对于正确选择抗体和操作方案很有帮助。实际表位图谱或序列数据固然有用,但并非保证抗体特异性必需的条件。
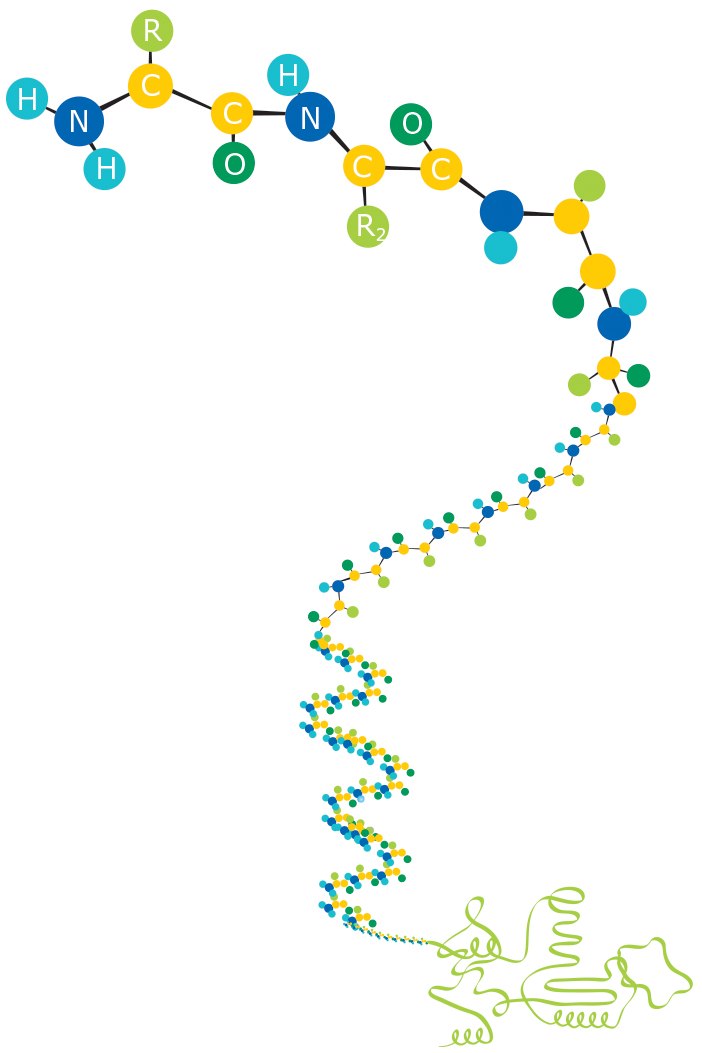
图 2.构成蛋白质的氨基酸。
结构
抗体以单拷贝或多拷贝的Y形单元形式存在,由四条多肽链组成。每个Y含有两个相同的重链拷贝和两个相同的轻链拷贝,以各自的相对分子量命名。这一Y形单元由两个可变的抗原特异性 F(ab)臂(对实际的抗原结合至关重要)、与免疫细胞Fc受体结合的恒定Fc“尾”(也可用作在大多数免疫化学程序中操纵抗体的有益“手柄”)组成。抗体上的F(ab)区域数量与其亚类相对应(见下文),并决定了抗体的价态(简而言之,抗体可与其抗原结合的“臂”的数量)。
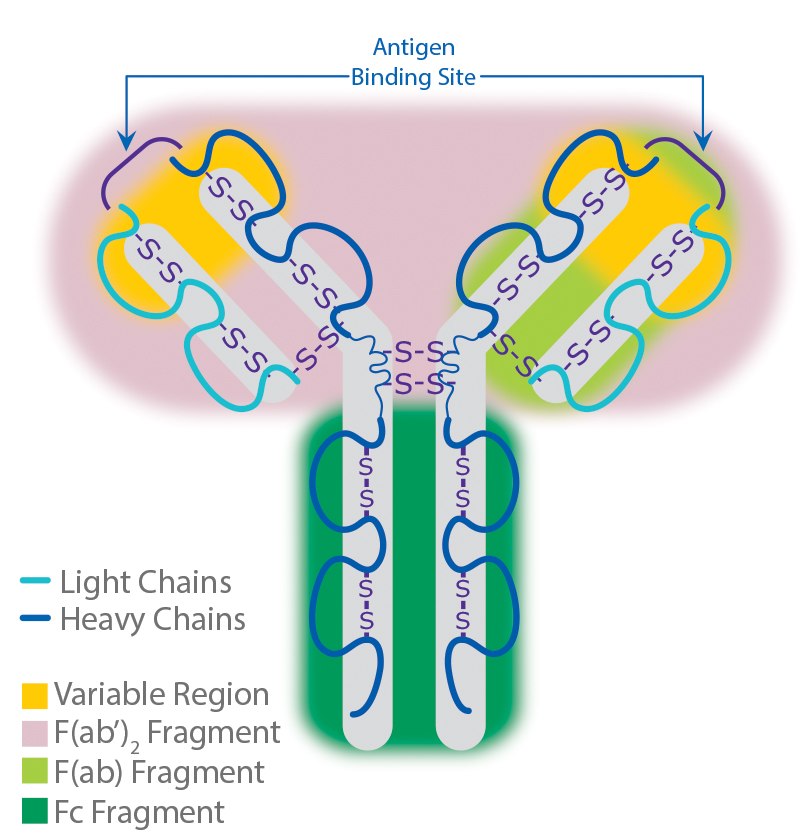
图 3.抗体结构。
这三个区域可被蛋白水解酶(瓜蛋白酶)切割成两个F(ab)和一个Fc片段,或被胃蛋白酶切割成F(ab')2和铰链区Fc两部分。片段化IgG抗体之所以有时有效,是因为F(ab)片段不会沉淀抗原,且在活体研究中不会被免疫细胞结合(缺乏Fc区)。
抗体压类
抗体可分为五类:IgG、IgM、IgA、IgD和IgE(基于Y单元的数量和重链类型)。IgG、IgM、IgA、IgD和IgE的重链分别称为g、μ、a、d和e链。所有抗体的轻链都可分为kappa(κ) 或lambda (λ)类(基于小分子多肽结构差异);但重链决定了每个抗体的亚类。
各抗体亚类在二硫键数量和铰链区长度方面存在差异。IgG类是血清中释放的主要免疫球蛋白类,是免疫化学操作步骤最常用的抗体。
IgA
在血液中,IgA以低含量单体形式存在。它们在粘膜表面活性最强,在此以二聚体形式存在并为粘膜表面提供主要防御功能。粘膜内层产生的IgA超过了所有其他类型抗体总和。其主要用作中和抗体。唾液、眼泪和母乳中存在较高含量的IgA。目前确知人类体内存在两种IgA亚型,而小鼠仅报道存在一种亚型。IgA1可能占血清总IgA的85%。选择性IgA缺乏症是最常见的免疫缺陷疾病之一,会增加感染的易感性。IgA缺乏症常见于自身免疫性疾病和过敏性疾病患者。IgA的半衰期约为5天。
IgD
这是一种具有两个表位结合位点的单体抗体,存在于大多数B淋巴细胞的表面。其确切功能仍然存在争议,但建议作为B细胞激活所需的抗原受体。据报道,IgD还可结合并激活嗜碱性粒细胞和肥大细胞,产生抗菌因子。还有人认为其具有消除B淋巴细胞的作用,可避免产生自身反应性自身抗体。IgD同样以分泌体形式产生,少量存在于血清中,含有两条δ类重链和两条轻链。IgD 的半衰期约为 3 天。
IgE
这是一组有效作用于粘膜表面、血液和组织的抗体。其以由两条重链(ε链)和两条轻链组成的单体形式存在。ε链包含4条Ig样恒定结构域。它在血清中以低浓度存在,仅占总血清抗体的约0.002%。多数IgE通过Fc区与其在肥大细胞和嗜碱性粒细胞上的受体紧密结合。这种抗体在超敏反应中起着至关重要的作用,生产过程受细胞因子严格控制。IgE的半衰期约为 2 天。
IgG
这是血液中最丰富的一类抗体,占总血清抗体的80%。它以单体形式存在。根据丰度,其可分为四个IgG亚类(IgG1>IgG2>IgG3>IgG4),产生的亚类取决于存在的细胞因子类型。
IgG1和IgG3对吞噬细胞上的Fc受体具有高亲和力,IgG2具有超低亲和力,而IgG4 对Fc受体具有中等亲和力。IgG能够离开循环系统并进入组织。IgG1、IgG3 和IgG4可以穿过胎盘屏障,为新生儿提供保护。IgG可有效激活补体系统,且可通过吞噬细胞上的Fc受体高效发挥调理作用。通过其Fc区,IgG还可以与自然杀伤细胞结合并参与抗体依赖性细胞毒性。IgG的半衰期为7至23天,具体取决于其亚类。
IgM
这类免疫球蛋白首先在感染时产生,存在于B细胞膜上,或以血浆细胞分泌的5亚基大分子存在。它也是第一个由新生儿合成的免疫球蛋白类别。表面IgM与其Fc区分泌形式不同。表面IgM作为完整的膜蛋白直接结合抗原,而不是与IgM Fc受体结合。分泌型IgM是一种五聚体分子,其中多个免疫球蛋白通过二硫键共价连接。这种结构提供了多个结合位点。每个单体由两条轻链(κ或λ)和两条重链组成。由于其五聚体性质,IgM特别适合激活补体、诱导凝集。IgM的半衰期约为5天。

图 4.纯重链抗体。
重链鲨鱼抗体(IgNAR)和重链骆驼抗体(hclgG)与普通抗体(IgG)的对比。重链以浓阴影显示,轻链以淡阴影显示。
相关产品
如要继续阅读,请登录或创建帐户。
暂无帐户?